某同学按下列操作进行实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度均为0.1mol/L的KBr、KI(含淀粉)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各一滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图),在圆心处放置2粒芝麻大小的KClO3晶体,向KClO3晶体滴加一滴浓盐酸,(ClO3—+5Cl—+6H+=3Cl2↑+3H2O),立即将表面皿盖好,有关反应的现象或对应的氧化还原反应的离子方程式不正确的是( )
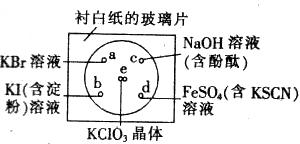
A.a处溶液显黄色:2Br—+Cl2=2Cl—+Br2
B.b处溶液显蓝色:2I—+Cl2=2Cl—+I2
C.c出溶液的红色褪去:2OH—+Cl2=Cl—+ClO—+H2O
D.d处溶液显红色:Fe2++Cl2=Fe3++2Cl—
答案:D
KClO3晶体与浓盐酸反应生成Cl2,Cl2与KBr反应生成黄色Br2,A正确;Cl2将KI氧化为I2,I2与淀粉变蓝,B项正确;Cl2与NaOH溶液反应,碱性减弱,红色消失,C项正确;Cl2将Fe2+氧化为Fe3+,与KSCN变红色,但方程式书写错误,电荷不守恒,不正确的是D。
