问题
填空题
(1) 硝酸在该反应中表现的性质为_______________________
(2) 当a=0.3 时,则反应中转移的电子数为________mol,若此时收集到的气体在标准状况下的体积为8.96L,则该气体为__________________。
(3) 用NH3吸收硝酸生产中产生的尾气是一种较为先进的吸收方法,其产物对环境无污染,目前在工业生产以及汽车尾气处理中已被广泛应用。试写出用NH3恰好吸收(2)所产生气体的总化学方程式______________________________
答案
(1)氧化性、酸性 (2) 0.6 NO、 NO2 (3) 3NO+9NO2+14NH3=13N2+21H2O
本题主要考查了氧化还原反应的电子守恒和配平。
(1)硝酸与金属反应时既表现氧化性又表现酸性。
(2)反应中转移的电子数为铜失去的电子数即:0.3 mol×2=0.6 mol,若收集到的气体全部为NO,则NO为0.6 mol/(5-2)=0.2 mol,若收集到的气体全部为NO2,则NO2为0.6 mol/(5-4)=0.6 mol。而实际气体为8.96L/22.4L/mol=0.4 mol。所以气体为NO和NO2。
(3)由(2)中的电子守恒可以求出NO和NO2的物质的量之比为1:3。而用NH3吸收尾气,其产物对环境无污染。所以产物为N2和H2O。由NO与NO2的固定关系,再根据得失电子守恒配平方程式。

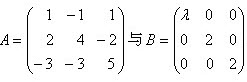 相似,则λ等于()
相似,则λ等于()