锆(Zr)是一种重要的稀有元素。
(1)由锆英石(ZrSiO4)可制取ZrOC12-8H2O
①用碳熔炼锆英石制碳化锆的化学方程式为:ZrSiO4+3C ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。
ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。
②用烧碱熔ZrC制取Na2ZrO3,完成该反应的化学方程式:
□ZrC+□NaOH+□ 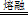 □Na2ZrO3+□CO2+□H2O
□Na2ZrO3+□CO2+□H2O
③碱熔料用盐酸浸出可得ZrOC12溶液。通过蒸发结晶从该溶液中获得ZrOC12-8H2O,还需用浓盐酸控制酸度,原因是 。
(2)ZrOC12-8H2O具有多方面的用途。用ZrOC12-8H2O和YC13制备Y2O3--ZrO2复合粉体的流程如下:
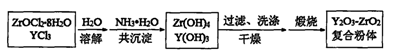
①共沉淀时,生成Zr(OH)4的化学方程式为 。
②当共沉淀恰好完全时,溶液中c(Zr4+)= 。
(已知Ksp[Zr(OH)4]=6.4×10—49,Ksp[Y(OH)3]=8.0×10—23;溶液中离子浓度为1×10-5mol•L-1时,可认为沉淀完全)
③将制得的一种复合粉体溶于水后,测得其微粒的平均直径为30 nm,该分散系属于 。
(15分)(1)①1∶2(2分) ②ZrC+2NaOH+2O2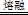 Na2ZrO3+CO2+H2O(3分)
Na2ZrO3+CO2+H2O(3分)
③防止ZrO2+的水解(2分)
(2)①ZrOCl2+2NH3•H2O+H2O=Zr(OH)4↓+2NH4Cl(3分)
②4.0×10—26mol•L—1(3分)
③胶体(2分)
题目分析:(1)①碳元素的化合价既升高又降低,C既是氧化剂又是还原剂,ZrC是还原产物,CO是氧化产物,且还原产物与氧化产物的物质的量之比为1∶2,则氧化剂与还原剂的物质的量或质量之比为1∶2;②碳元素由—4价升为+4价,被氧气氧化,氧元素由0价降为—2价,根据化合价升降总数相等、原子守恒配平可得,ZrC+2NaOH+2O2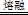 Na2ZrO3+CO2+H2O;③用盐酸酸浸、控制酸度的主要目的是抑制盐类的水解或防止ZrO2+的水解;(2)①读图可知,共沉淀发生复分解反应,则反应式为ZrOCl2+2NH3•H2O+H2O=Zr(OH)4↓+2NH4Cl;②当Y3+沉淀完全时,由Y(OH)3(s)
Na2ZrO3+CO2+H2O;③用盐酸酸浸、控制酸度的主要目的是抑制盐类的水解或防止ZrO2+的水解;(2)①读图可知,共沉淀发生复分解反应,则反应式为ZrOCl2+2NH3•H2O+H2O=Zr(OH)4↓+2NH4Cl;②当Y3+沉淀完全时,由Y(OH)3(s) Y3+(aq)+3OH—(aq)可知,c(OH—)=
Y3+(aq)+3OH—(aq)可知,c(OH—)=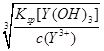 =
=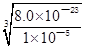 =2.0×10—6mol•L—1,由Zr(OH)4(s)
=2.0×10—6mol•L—1,由Zr(OH)4(s) Zr4+(aq)+4OH—(aq)可知,c(Zr4+)=
Zr4+(aq)+4OH—(aq)可知,c(Zr4+)=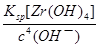 =
=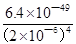 mol•L—1=4.0×10—26mol•L—1;③1nm<30nm<100nm,则该分散系属于胶体。
mol•L—1=4.0×10—26mol•L—1;③1nm<30nm<100nm,则该分散系属于胶体。
