问题
问答题
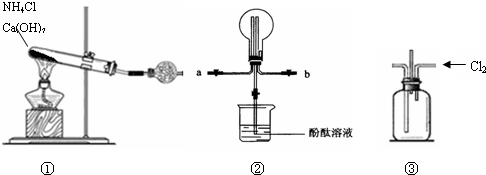
某化学实验小组同学利用下列装置制备干燥氨气,并探究氨气的性质(部分仪器已略去).请回答:
(1)实验室制备氨气的化学方程式为______.
(2)收集氨气时,请你选择氨气的进气口______(填“a”或“b”).
(3)若观察到装置②中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是______.
(4)在常温下将氨气和氯气同时通入装置③混合即发生反应,生成某单质气体并产生白烟.试写出反应的化学方程式______;若从装置③中间导管处逸出的尾气中含有少量Cl2,为防止污染环境可将尾气通过盛有______的洗气瓶.
答案
(1)氯化铵和氢氧化钙反应生成氨气、水和氯化钙.
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O. △ .
(2)氨气的密度小于空气的密度,所以要采用向下排空气法收集氨气,即a 为进气口,b为出气口.
故答案为:a.
(3)氨气极易溶于水,形成较大压强差,所以能形成喷泉;氨气溶于水生成氨水,氨水电离出自由移动的氢氧根离子,所以溶液呈碱性,加入酚酞后溶液呈红色.
故答案为:极易溶于水,与水反应生成碱.
(4)氨气和氯气反应生成单质氮气和白烟,白烟是氯化铵固体,
氯气能和水反应生成酸,酸和碱能发生中和反应,所以可用氢氧化钠溶液吸收氯气.
故答案为:8NH3+3Cl2═N2+6NH4Cl; 氢氧化钠溶液
