氯化亚铜(CuCl)是重要的化工原料。工业上常通过下列反应制备CuCl:
2CuSO4+Na2SO3+2NaCl+Na2CO3→2CuCl↓+3Na2SO4+CO2↑
⑴ CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为 。
⑵ 准确称取所配制的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60mLCe(SO4)2溶液。有关反应的离子方程式为:
Fe3++CuCl→Fe2++Cu2++Cl- Ce4++Fe2+→Fe3++Ce3+
已知国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。试通过计算说明上述样品中CuCl的质量分数是否符合国家标准。
(1) 5∶11(2分)
(2)设样品中CuCl的质量为x,由化学方程式可知:
CuCl ~ Fe2+ ~ Ce4+
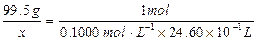
x=0.1000mol·L-1×24.60×10-3L×99.5g·mol-1="0.2448g " (1分)
样品中CuCl的质量分数=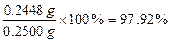 >96.50% (1分)
>96.50% (1分)
故样品中CuCl的质量分数符合国家标准。(1分)
