硝土中含有硝酸镁、硝酸钙、氯化钠等物质,草木灰的主要成分是碳酸钾,民间曾用硝土和草木灰作原料来制取硝酸钾.其主要生产流程为:
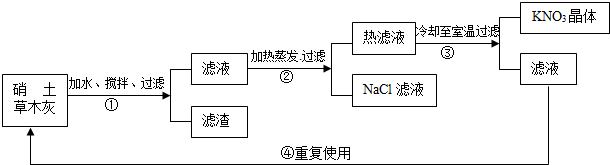
(1)写出步骤①中生成MgCO3沉淀的化学方程式:______,反应类型:______.
(2)步骤④中滤液可重复使用的理由是______.
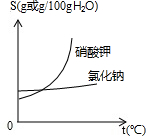
(3)参考右图,解释生产流程中用蒸发结晶得到NaCl晶体,而用冷却结晶得到KNO3晶体的原因:______.
(4)不同植物燃烧得到的草木灰中碳酸钾的含量不同.为测定玉米杆燃烧得到的草木灰中钾元素的质量分数,某同学称取了100g该草木灰,向其中加入足量的稀硫酸,待完全反应后,收集到6.6gCO2气体(假设草木灰中其它成分不与酸反应).
求:①100g草木灰中K2CO3的质量.
②该草木灰中钾元素的质量分数.
(1)由题意“硝土中含有硝酸镁、硝酸钙、氯化钠等物质,草木灰的主要成分是碳酸钾,民间曾用硝土和草木灰作原料来制取硝酸钾”则可知生成MgCO3沉淀的化学方程式Mg(NO3)2+K2CO3═MgCO3↓+2KNO3;反应符合“‘双交换,价不变’,内项结合,外项结合”,反应为复分解反应;
(2)步骤④中滤液可重复使用的理由是滤液中含有较多的KNO3;
(3)解释生产流程中用蒸发结晶得到NaCl晶体,而用冷却结晶得到KNO3晶体的原因:NaCl的溶解度受温度变化的影响较小,KNO3的溶解度受温度变化的影响较大;
(4)设碳酸钾的质量为x,其中钾元素的质量为y,.
K2CO3+H2SO4═K2SO4+H2O+CO2↑
138 44
x 6.6
=138 x
,x=20.7g44 6.6g
钾元素的质量为
×100%×20.7g=11.7g78 138
钾元素在草木灰中的质量分数为
×100%=11.7%11.7g 100g
答:碳酸钾质量为20.7克,钾元素的质量分数为11.7%
故答为:(1)Mg(NO3)2+K2CO3═MgCO3↓+2KNO3,复分解反应
(2)滤液中含有较多的KNO3(或重复利用滤液中的KNO3,节约原料,提高原料的利用率)
(3)NaCl的溶解度受温度变化的影响较小,KNO3的溶解度受温度变化的影响较大.
(4)100g草木灰中碳酸钾质量为20.7克,该草木灰中钾元素的质量分数为11.7%
