问题
填空题
某体系中存在如下反应:
①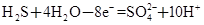 ②
②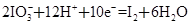
(1)反应①中H2S作_______剂,反应②属于_______反应。(填“氧化”或“还原”)
(2)若在反应①中失去0.2 mol电子,则反应②中可生成_______g碘。
(3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:______。
(4)由上述反应可推知_______。
a.氧化性:K2SO4>KIO3 b.酸性:HIO3>H2SO4
c.还原性:H2S>I2 d.反应过程中溶液的酸性逐渐减弱
答案
(1)还原 还原 (2)5.08
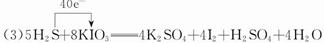
(4)c
(1)反应①中S元素化合价升高,是氧化反应,H2S作还原剂。反应②中I元素化合价降低,是还原反应。
(2)氧化还原反应中得失电子数相等,反应①中失去0.2 mol 电子,反应②中必然得到0.2 mol电子,生成碘0.02 mol,质量为5.08 g。
(3)调整化学计量数使两个方程式得失电子数相等,将两个方程式相加,电子由S转移到I,电子转移数为40。
(4)根据氧化剂的氧化性大于氧化产物的氧化性知氧化性KIO3>K2SO4,同理,还原性H2S>I2,反应过程中有H2SO4生成,酸性逐渐增强,根据该反应无法比较HIO3、H2SO4的酸性,故只有c正确

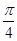 ) 和x2 ="9asin" (8πbt +
) 和x2 ="9asin" (8πbt +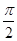 ),其中a、b为正的常数,则它们的:①振幅之比为 ;②摆长之比为 。
),其中a、b为正的常数,则它们的:①振幅之比为 ;②摆长之比为 。