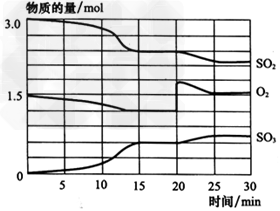
一定条件下,将SO2和O2充入一个体积为2L的密闭容器中,发生如下反应:2SO2(g)+O2(g)
 2SO3(g),反应过程中SO2、O2、SO3物质的量变化如图所示。
2SO3(g),反应过程中SO2、O2、SO3物质的量变化如图所示。
回答下列问题:
(1)0~15min内SO2的平均反应速率为__________。
(2)当降低温度时,SO2的转化率增大,则该反应正反应为_________(填“吸热”或“放热”)反应。
(3)若反应达到平衡后,其他条件不变,向该容器中充入2mol SO2气体,则平衡常数K____(填“增大”“减小”或“不变”)。
(4)反应处于平衡状态的时间是____,则该温度下的平衡常数K为____(保留2位小数);若t℃时平衡常数为K1,(t+50)℃时平衡常数为K2,则K1____(填“>” “<”或“=”)K2。
(5)反应进行至20min时,曲线发生变化的原因是 _____________(用文字表达);10~15min的曲线变化的原因可能是_____(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
(6)某温度下的平衡常数K=532.4,各物质的浓度如下,c(SO2)=0.0600mol/L,c(O2)=0.4000mol/L, c(SO3)=2.000mol/L,请判断反应进行的方向:________。
(1)0.02mol/(L·min)
(2)放热
(3)不变
(4)15~20min;0.10;>
(5)增加了O2的量;ab
(6)向逆反应方向进行
