研究氮及其化合物的性质在人类进步过程中具有极为重要的意义。
(1)自然界中存在着各种固氮反应,写出大气中雷电作用时的固氮反应的化学方程式:__________________
(2)已知反应:
①2H2(g)+O2(g) 2H2O(g) △H=-483.6kj/mol
2H2O(g) △H=-483.6kj/mol
②N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
③4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ/mol
4NO(g)+6H2O(g) △H=-905kJ/mol
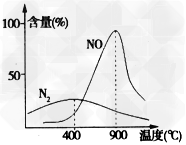
则反应④4NH3(g)+3O2(g) 2N2(g)+6H2O(g)的△H=___________。如图是在一个密闭容器内,在催化剂作用下,一定量的氨气与氧气的混合气体在不同温度时的生成物及生成物含量与温度的关系图:温度较低时以反应_______(选填上述已知反应序号“①、②、③或④”)为主,当温度高于900℃时,NO产率下降的原因____。
2N2(g)+6H2O(g)的△H=___________。如图是在一个密闭容器内,在催化剂作用下,一定量的氨气与氧气的混合气体在不同温度时的生成物及生成物含量与温度的关系图:温度较低时以反应_______(选填上述已知反应序号“①、②、③或④”)为主,当温度高于900℃时,NO产率下降的原因____。
(3)在实验室中,某同学利用下列试剂及器材完成的实验能够证明NH3·H2O是弱电解质的是_________(选填字母代号)。
a.用氨水做导电性实验,灯泡昏暗
b.将氨水滴入AlCl3溶液中,产生白色沉淀
c.常温下,用pH试纸测得0.1mol/L氨水的pH<13
d.用湿润的篮色石蕊试纸测得NH4Cl溶液为红色
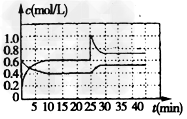
(4)在一定温度下,在一容积为2L的密闭容器中,通入一定量NO2和N2O4的混合气体,测得这两种物质的浓度随时间的变化关系如图所示。0~10min内N2O4的化学反应速率v(N2O4)=_______,在第25min时,容器内两种物质的浓度突然发生变化,出现这种现象的原因是_________,35min时, 反应N2O4 2NO2的化学平衡常数K=________。
2NO2的化学平衡常数K=________。
(1)N2(g)+O2(g) 2NO(g)
2NO(g)
(2)-1266kJ/mol;④;生成NO的反应为放热反应,温度高于900℃时,升高温度,平衡向左移动,产率下降
(3)e
(4)0.02mol/(L·min);增大了NO2的浓度;0.9mol/L
