自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
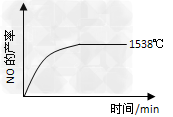
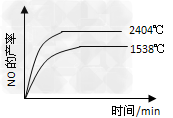
(1)已知反应N2(g)+O2(g) 2NO(g) △H=+180KJ/mol 其他条件相同时,在不同的温度下分别发生该反应。已知1538℃时,NO的产率随时间变化如图所示,请补充完成2404℃时NO的产率随时间变化的示意图。
2NO(g) △H=+180KJ/mol 其他条件相同时,在不同的温度下分别发生该反应。已知1538℃时,NO的产率随时间变化如图所示,请补充完成2404℃时NO的产率随时间变化的示意图。
(2)①2404℃时,反应N2(g)+O2(g) 2NO(g)的平衡常数为64,在容积为1.0L的密闭容器中通入2mol N2和2mol O2,计算反应N2(g)+O2(g)
2NO(g)的平衡常数为64,在容积为1.0L的密闭容器中通入2mol N2和2mol O2,计算反应N2(g)+O2(g) 2NO(g)达到平衡时N2的转化率。(此温度下不考虑O2与NO的反应。要求写出计算过程,计算结果保留两位有效数字)
2NO(g)达到平衡时N2的转化率。(此温度下不考虑O2与NO的反应。要求写出计算过程,计算结果保留两位有效数字)
②其他条件不变的情况下,将容器的体积压缩到原来的一半,对平衡体系产生的影响正确的是:________(填字母)。
A.c(N2)增大
B.正反应速率加快,逆反应速率减慢
C.NO的物质的量增加
D.重新平衡时c(N2)/ c(NO)不变
(3)在一定条件下,N2在催化剂表面与水反应,相应的热化学方程式如下:2N2(g)+6H2O(1) =4NH3(g)+3O2(g) △H=+1530kJ/mol
则氨气与氧气催化氧化生成一氧化氮和水的热化学方程式为_____________________。
(1)
(2)① 设NO的平衡浓度为x
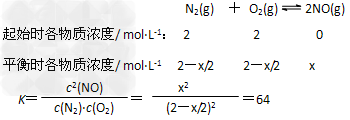
N2的转化率为80%
②AD
(3)4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H=—1170 kJ·mol-1
