开源节流是应对能源危机的重要举措.
(1)下列做法有助于能源“开源节流”的是______(填字母).
a.大力开采煤、石油和天然气以满足人们日益增长的能源需求
b.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)氢能是理想的清洁能源.下列制氢的方法中,最节能的是______(填字母).
a.电解水制氢:2H2O
2H2↑+O2↑ 电解 .
b.高温使水分解制氢:2H2O
2H2↑+O2↑ 高温 .
c.太阳光催化分解水制氢:2H2O
2H2↑+O2↑ TiO2 . 太阳光
d.天然气制氢:CH4+H2O
CO+3H2高温
(3)利用MnFe2O4通过两步反应使水分解制氢气,第一步反反应为:MnFe2O4
MnFe2O4-X+ >1000K .
O2,则第二步反应的化学方程式为______(条件不写).X 2
(4)如图是以SO2、I2、H2O为原料,利用核能使水分解制氢气的一种流程.
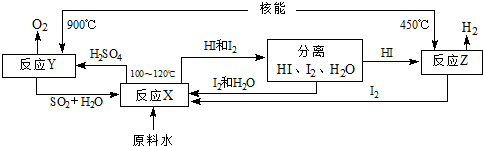
反应X的化学方程式为______,该流程中循环使用的原料有______.从理论上讲,该流程中,1mol原料水制得______molH2.
(1)只要能减少自然资源的运用都属于“开源节流”.
a、不能减少自然资源的运用,故错误.
b、c、d能减少自然资源的运用,故正确.
故选bcd.
(2)最节能的方法是运用太阳能,高温、电解都需要其它自然资源,故选C.
(3)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气,反应方程式为MnFe2O4-X+xH20=MnFe2O4+xH2↑.
故答案为:MnFe2O4-X+xH20=MnFe2O4+xH2↑.
(4)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸,反应方程式为SO2+I2+2H2O=2HI+H2SO4;根据流程图知,该流程中循环使用的原料有SO2、I2;一个H2O中含有2个氢原子,所以水分子和氢分子的个数之比是1:1,故从理论上讲,该流程中,1mol原料水制得1mol氢气.
故答案为:SO2+I2+2H2O=2HI+H2SO4;SO2、I2;1.
