工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2 (g)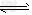 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2
B.向装置中充入过量的SO2
C.向装置中充入O2
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g) ,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于 5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10 M Pa。试计算反应 2SO3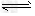 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。

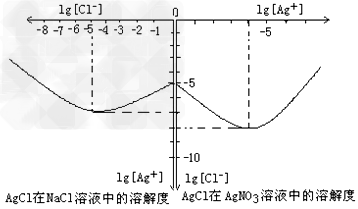
⑷沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- =[AgCl2]-,下图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________
(1)C
(2)CD
(3)2.5×10-4;常压下400~500°C,SO2转化率已经很高了,加压必须增大投资以解决增加设备和提供能量问题;=
(4) ①10-10;②开始Cl-抑制了AgCl 的溶解,所以Ag+浓度变小了,但Cl-浓度增大使AgCl 形成[AgCl2]-络合物,所以Ag+浓度又变大了。
