(15分)某实验小组同学对电化学原理进行了一系列探究活动。
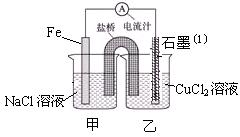
(1)右图为某实验小组依据氧化还原反应:(用离子方程式表示) 设计的原电池装置,一段时间后,两电极质量相差12g,导线中通过 mol电子。
(2)其它条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为 ,这是由于NH4Cl溶液显 性,(填酸性、碱性或中性)用离子方程式表示溶液显此性的原因 ,用吸管吸出铁片附近溶液少许至于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 ,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
(3)如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是 ,电极反应为 ;乙装置中石墨(1)为 极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为 ,产物常用 检验,反应的离子方程式为 。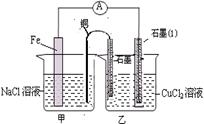
(1)Fe +Cu2+ ="==" Fe2+ + Cu (1分) 0.2mol。(1分)
(2)2H+ + 2e-="==" H2↑;酸(各1分) NH4+ + H2O  NH3·H2O + H+(1分)
NH3·H2O + H+(1分)
2Fe2+ + Cl2="==" 2Fe3+ + 2Cl- (1分) 2Fe3++3Cl2+8H2O==2FeO42- +6Cl- (2分)
(3)溶液变红(1分) O2+2H2O+4e—="==" 4OH—(2分) 阴(1分),2Cl——2e—===Cl2↑(1分),
湿润淀粉碘化钾试纸(1分), Cl2 + 2I- ="=" 2Cl— +I2 (1分) 。
