(10分)某校课外实验小组进行铜与浓、稀硝酸反应的实验研究。基本原则是:安全可靠、现象明显,符合环保要求。
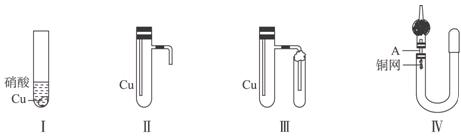
如果用图Ⅰ中装置进行铜与浓硝酸反应的实验,最大缺点是产生的NO2气体逸出污染空气;如果用该装置来证明铜与稀硝酸反应生成NO气体,缺点是不易观察到有毒性的NO气体无色的本来面目。
(1)若用装置Ⅱ进行实验,既可克服实验不足,还能使上述反应在同一试管中连续进行。实验如下:组装好装置并检查气密性后,加入2 mL浓硝酸(铜片未接触酸液),塞紧胶塞;向左倾斜试管使其反应发生,当导管口有极少量红棕色气体逸出,溶液呈绿色时,正立试管,使反应停止;同时将导管插入水中,稍后能观察到:a.水沿导管倒吸至试管中,b.________________,c. ________________等明显现象。其中发生的原因用方程式表示为:_________________________________________________________。
(2)当试管中液体体积约占1/2时,从水中取出导管,并伸入一小试管中,管口塞上浸有碱液的棉花(如图Ⅲ)。这样做的目的是:________________,此时大试管中反应的离子方程式为:________________________________________________。
(3)若用右上图Ⅳ所示的装置(U形管、干燥管、A为活塞)制取NO可能更加理想。请补充下列实验步骤:
①检查装置的气密性的方法是:________________________________________________。
②打开活塞A,从U形管右端注入稀硝酸,直到________________________为止。
③关闭活塞A,若反应缓慢,可在U形管左侧加热,观察到____________________。
(1)试管内颜色由红棕色变为无色 铜丝表面产生气泡 3NO2+H2O====2HNO3+NO
(2)防止刺激性和有毒气体污染空气 3Cu+8H++2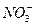 ====3Cu2++2NO↑+4H2O(3)①关闭活塞A,向U形管长管一端加入水至液面高于短管,静置,一段时间后如果液面高度差不变,则气密性好 ②液面到达活塞A处(U形短管内无气柱) ③铜丝上有气泡冒出,生成无色气体,U形管左端液面下落(第3小题的第1、3两空每空2分,其余每空1分)
====3Cu2++2NO↑+4H2O(3)①关闭活塞A,向U形管长管一端加入水至液面高于短管,静置,一段时间后如果液面高度差不变,则气密性好 ②液面到达活塞A处(U形短管内无气柱) ③铜丝上有气泡冒出,生成无色气体,U形管左端液面下落(第3小题的第1、3两空每空2分,其余每空1分)
本题关键是铜与浓稀硝酸反应产生不同的有毒有害气体,反应原理:Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑(红棕色)+2H2O;3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O。由图Ⅰ装置进行制取NO,缺点很多,污染环境。由图Ⅱ装置完成该实验时,因Cu与浓硝酸反应,在铜丝表面冒出气泡,还生成大量的红棕色气体NO2,Cu(NO3)2溶液呈绿色。当停止反应后将导管插入水中,NO2与H2O反应迅速减小试管内的压强,就会有倒吸现象,使水进入大试管中,反应继续进行。当水上升到1/2时,取出导管伸入一支带有碱液棉花的小试管,碱液吸收NO气体,防止污染空气。这样的操作较烦琐,难免有极少量NO2、NO气体逸出。可以用图Ⅳ装置制取NO更加绿色化。操作步骤如下:①关闭活塞A,向U形管长管一端加水至液面高于短管,静置,如果长管与短管液面高度之差不变化,说明U形管的气密性好。②打开活塞A,从短管注入稀硝酸,直到液面到达活塞A处(U形管短管一端无气柱)为止。③关闭活塞A,观察到铜网表面上有气泡冒出,同时生成无色气体,也就是NO气体,U形管长管内的液面逐渐下降。
