问题
填空题
某化学反应2A(g)  B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
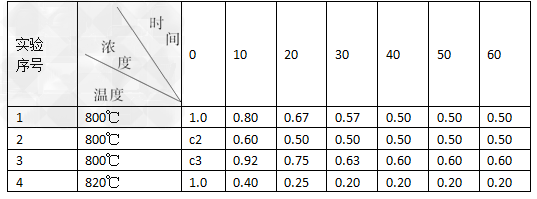
根据上述数据,完成下列填空:
(1) 在实验1,反应在10至20分钟时间内平均速率为________mol/(L·min)。
(2) 在实验2,A的初始浓度c2=________mol/L,推测实验2中还隐含的条件是____________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3________v1(填>、<、=),且c3________1.0 mol/L(填>、<、=)
(4)比较实验4和实验1,可推测该反应是____________反应(选填“吸热”、“放热”)。理由是____________________。
答案
(1) 0.013
(2) 1.0;加入了催化剂
(3)>;>
(4) 吸热;温度升高,A的平衡浓度减小,说明平衡正向移动,则正向为吸热反应
