(12分)
|
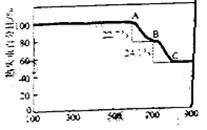
实验曲线如右图(MgCO4的分解温度比CaCO2
低)
①700℃(即B点)对剩余固体的主要成分为
(填化学式)。
②该白云石中MgCO3的质量分数为
(保留3位有效数字)。
(2)乙同学利用滴定法测定白云石中MgCO3的含量。已知:①滴定时,EDTA分别有Ca2+或Mg2+以物质的量之比1:1进行反应,可用K—B指示剂作为该滴定反应的指示剂;②实验条件下。Mg2+开始沉淀时的pH为10,沉淀完全时的pH为11.2,Ca2+开始沉淀时的pH为12。
步骤1:准确称取白云石试样m g,在烧杯中用适量稀盐酸完全溶解;
步骤2:冷却后全部转移到250mL容量瓶中定容,
步骤3:从容量瓶中移取试液25.00mL,用NaOH溶液调节溶液pH约为9.5;
步骤4:加入2滴K—B指示剂,以c mol/L的EDTA标准溶液滴定至终点,消耗EDTA溶液V1mL;
步骤5:再从容量瓶中移取试液25.00mL, ;
步骤6:加入2滴K—B指示剂,继续以c mol/L的EDTA标准溶液滴定至终点,消耗EDTA溶液V2mL。
①根据上述分析数据,测得该白云石试样中MgCO3的质量分数为 (用含字母的代数式表示)。
②配制100mL c mol/L EDTA标准溶液,需要用到的玻璃仪器有烧杯、玻璃棒、量筒,
。
(12分)
(1)①MgO和CaCO3(2分) ②43.3%或0.433(2分)
(2)用NaOH溶液调节pH至11.2~12之间(3分)
①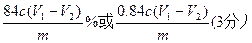 ②100mL量瓶 胶头滴管(2分)
②100mL量瓶 胶头滴管(2分)