(10分)利用化学原理可以对工厂排放的废水进行有效检测和合理处理。
(1)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润红色石蕊试纸变蓝的气体)。除去NO2-离子的离子方程式是
▲ 。
(2)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
①方法一:将Ca(OH)2或CaO投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7mol/L时,溶液中c(PO43-)= ▲
(已知常温时,KSP[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石——鸟粪石,反应的方程式为Mg2++ NH4++ PO43-= MgNH4 PO4。该方法中需要控制污水的pH为7.5-10,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能是 ▲ 。与方法一相比,方法二的优点是 ▲ 。
(3)三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:
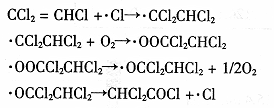
该反应的总化学方程式为 ▲ 。
(1)2Al+OH-+NO2-+2H2O=2AlO2-+NH3?H2O
(2)①5×10-7
②当pH高于10.7时,溶液中的NH4+、Mg2+会与OH—反应
能充分除去废水中的氮,充分利用镁矿工业的废水。
(3)2CCl2=CHCl+O2=2CHCl2COCl
(每空2分,共10分)
(1)由题信息可得,生成使湿润红色石蕊试纸变蓝的气体为NH3,所以反应的离子方程式为:2Al+OH-+NO2-+2H2O=2AlO2-+NH3?H2O
(2)①KSP[Ca3(PO4)2]=c(Ca2+)3×c(PO43-)2=(2×10-7)2×c(PO43-)2得,c(PO43-)=5×10-7;
②pH高于10.7,鸟粪石的产量会大大降低,其原因可能是:溶液中的NH4+、Mg2+会与OH—反应
与方法一相比,方法二的优点是:能充分除去废水中的氮,充分利用镁矿工业的废水。
(3)根据反应机理,将方程式叠加得该反应的总化学方程式为:2CCl2=CHCl+O2=2CHCl2COCl
