(10分)某研究性学习小组为探究Cu(OH)2受热分解产物及产物性质,设计如下实验。
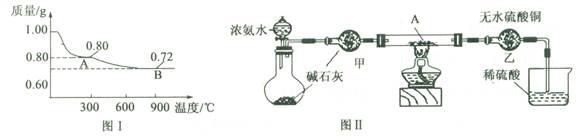
(1)取0.98 g Cu(OH)2固体加热,质量随温度变化的曲线如图1所示,产物A、B的化学式分别为 和 。
(2)取少量产物B加入足量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,该反应的离子方程式为 。
(3)为证明产物A在加热时能与NH3反应,某同学设计了如图Ⅱ(夹持装置未画出)所示实验装置。
①简述检查该装置气密性的方法 。
②实验过程中观察到两个明显现象: i直玻璃管中固体由黑色变为红色;ii装置乙中固体由白色变为蓝色。能证明产物A与NH3发生了反应的判断依据的是 (填选项字母)。
a.只有i可以 b.只有ii可以 c.i或ii都可以
(1)CuO Cu2O
(2)Cu2O + 2H+ = Cu2+ + Cu + H2O
(3)①如图连接装置,关闭分液漏斗旋塞,将末端导管浸入水中;用热毛巾捂住烧瓶底部,若导管口有气泡连续冒出,撤掉热毛巾,冷却至室温后导管内形成一段液柱且持续不落,则证明装置气密性良好。
②b
(1)不溶于水解的碱Cu(OH)2可加热脱水:Cu(OH)2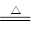 CuO+H2O,由反应前后两固体物质的质量比为98:80≈1.00:0.80可猜测出A物质为CuO
CuO+H2O,由反应前后两固体物质的质量比为98:80≈1.00:0.80可猜测出A物质为CuO
铜的氧化物有CuO及Cu2O,CuO加热质量继续减小,根据反应:4CuO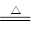 2Cu2O+O2↑可看出,反应前后两固体物质的质量比为80:72,符合题意,故可知B物质为Cu2O
2Cu2O+O2↑可看出,反应前后两固体物质的质量比为80:72,符合题意,故可知B物质为Cu2O
(2)Cu2O在酸性条件下生成了铜单质及硫酸铜,即岐化反应:Cu2O + 2H+ = Cu2+ + Cu + H2O
(3)①关闭分液漏斗旋塞,将末端导管浸入水中;用热毛巾捂住烧瓶底部,若导管口有气泡连续冒出,撤掉热毛巾,冷却至室温后导管内形成一段液柱且持续不落,则证明装置气密性良好。
②由题意知道,CuO加热可分解生成红色的Cu2O,故“直玻璃管中固体由黑色变为红色”,不能说明氨气与CuO参加了反应;
由于氨气经干燥管吸水后得到无水的氨气,而无水硫酸铜变蓝,说明有水生成,而其中的氢元素只能来自于氨气,故此现象可做为氨气参加反应的依据
b选项符合题意
