(11分)(1)在实验室里可以用浓盐酸跟二氧化锰起反应制取氯气,反应的化学方程式为:______________________________________________________。
(2)往过氧化氢溶液中加入二氧化锰粉末可以产生氧气,此反应中二氧化锰的作用是_____________。
(3)在SO2、CaO、D2、HCl、Na2CO3五种纯物质中,属于共价化合物的是_________________________;含非极性键的是_______________。
(4)已知:2 SO2 + O2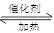 2 SO3。向一密闭容器中充入SO2与18O2,反应一段时间后,含18O的物质是_______________________。
2 SO3。向一密闭容器中充入SO2与18O2,反应一段时间后,含18O的物质是_______________________。
(5)如下反应:
① Zn + CuSO4 = ZnSO4 +Cu ② NaOH + HCl =" NaCl" + H2O
③ 4Al + 3O2 = 2Al2O3 ④ Na2CO3 + H2SO4 = Na2SO4 + CO2↑+ H2O
其中可以设计成原电池的是_______________(写序号)。
(1)MnO2 + 4HCl(浓) MnCl2 + Cl2↑+2H2O(2分)
MnCl2 + Cl2↑+2H2O(2分)
(2)作催化剂(1分) (3)SO2、HCl(2分);D2(1分)
(4)O2、SO2、SO3(3分) (5)①③(2分)
(1)二氧化锰在加热时,能氧化浓盐酸生成氯气,方程式为MnO2 + 4HCl(浓) MnCl2 + Cl2↑+2H2O。
MnCl2 + Cl2↑+2H2O。
(2)过氧化氢能分解生成氧气和水,在催化剂的作用下,可以加快分解速率,因此二氧化锰起催化剂的作用。
(3)全部由共价键形成的化合物是共价化合物,所以SO2、HCl是共价化合物。氧化钙和碳酸钠是离子化合物。由同一种非金属形成的共价键是非极性键,所以D2是由非极性键形成的单质。
(4)因为是可逆反应,所以在生成三氧化硫的同时,三氧化硫又分解生成氧气和二氧化硫,即O2、SO2、SO3中均含有18O。
(5)原电池中有电子定向移动,所以只有氧化还原反应才能设计成原电池,即①③可以。
