(13分)根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
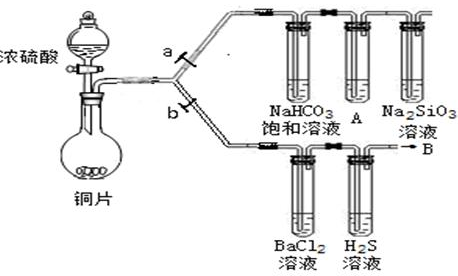
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、检验装置气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是___________________________。装置A中试剂是________________。
③能说明碳的非金属性比硅强的实验现象是________________________________________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是______________________________________。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
④将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入一定量的B气体,实验过程中可得到沉淀的最大质量为1.2g。
试计算:原混合物中KOH的质量为_____________g。生成沉淀质量为最大时,消耗B气体(标准状况下)的体积(V)范围是:_____________________________________。
(1)② Cu + 2H2SO4(浓) 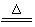 CuSO4 + SO2↑+ 2H2O KMnO4溶液
CuSO4 + SO2↑+ 2H2O KMnO4溶液
③A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀
(2)②2H2S + SO2 =" 3S↓" + 2H2O
③
| BaSO4 | BaSO3 |
Ba2+ + SO2 + Cl2 + 2H2O ="=" BaSO4↓+ 4H+ + 2Cl—
④0.56g 224mL ≤ V ≤ 448mL
(注:本题下载后无题文部分)
(1)② Cu + 2H2SO4(浓)  CuSO4 + SO2↑+ 2H2O KMnO4溶液
CuSO4 + SO2↑+ 2H2O KMnO4溶液
③A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀
(2)②2H2S + SO2 =" 3S↓" + 2H2O
③
| BaSO4 | BaSO3 |
Ba2+ + SO2 + Cl2 + 2H2O ="=" BaSO4↓+ 4H+ + 2Cl—
④0.56g 224mL ≤ V ≤ 448mL
CO2通入KOH和Ca(OH)2的混合溶液中,第一步反应为
Ca(OH)2+CO2 CaCO3↓+H2O,Ca(OH)2恰好反应完时沉淀质量最大,此时可由0.01 mol CO2来算Ca(OH)2和CaCO3的物质的量为0.01 mol。第二步反应为KOH+CO2
CaCO3↓+H2O,Ca(OH)2恰好反应完时沉淀质量最大,此时可由0.01 mol CO2来算Ca(OH)2和CaCO3的物质的量为0.01 mol。第二步反应为KOH+CO2 KHCO3,KOH的质量为(1.3-0.01×74)g="0.56" g,所以n(KOH)="0.01" mol,第二步消耗的CO2也为0.01 mol ,第三步CaCO3+CO2+H2O
KHCO3,KOH的质量为(1.3-0.01×74)g="0.56" g,所以n(KOH)="0.01" mol,第二步消耗的CO2也为0.01 mol ,第三步CaCO3+CO2+H2O Ca(HCO3)2,又消耗0.01 mol CO2。最后一问上面第二步反应沉淀最大且质量不变,消耗CO2的值为0.01mol―0.02mol之间,体积为224mL ≤ V ≤ 448mL。
Ca(HCO3)2,又消耗0.01 mol CO2。最后一问上面第二步反应沉淀最大且质量不变,消耗CO2的值为0.01mol―0.02mol之间,体积为224mL ≤ V ≤ 448mL。

