问题
实验题
甲酸为不溶于水易溶于乙醇的无色晶体,苯酚常温下能溶于水,易溶于酒精。酸性强弱为:盐酸>苯甲酸>碳酸>苯酚>碳酸氢钠。现有苯甲酸、苯酚一起溶于乙醇所得的混合液,设计一个简单的实验方案,把这三种物质分离为各自的纯净物。按分离的先后顺序的多种可能方案:
方案一:按酸性由弱到强顺序分离
方案二:按酸性由强到弱顺序分离;
……
供选择试剂:①10%氢氧化钠溶液②37%盐酸③Na2CO3溶液④NaHCO3溶液⑤大理石⑥KMnO4溶液⑦生石灰⑧10%H2SO4
(1) 甲同学按实验方案一进行,请填写相关内容。
| 实验步骤 | 写出相应的离子方程式 |
| ①取试样加入足量10%的NaOH溶液,充分振荡后再将反应混合物倒入蒸馏烧瓶中蒸馏得到乙醇、水的混合物和产品A | ①OH-+C6H5-OH→C6H5O-+H2O ② |
| ②向步骤①的馏分中加入足量的生石灰,再次蒸馏浓缩,蒸气冷凝后得乙醇。 | CaO+H2O=Ca(OH)2 |
| ③向产品A中通入足量CO2,静置后分液得 和溶液B。 |
|
| ④再向溶液B中加入足量 、静置、过滤后可得苯甲酸。 |
|
(3)方案一需要制取CO2应选用下述哪种装置 (填符号),该装置检验气密性的方法是 。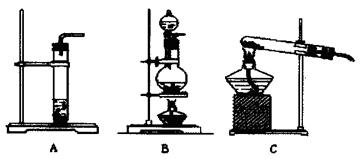
答案
(1)方案一:7分(离子方程式与各空均为1分)
| 实验步骤 | 写出相应的离子方程式 |
| OH-+C6H5-COOH→C6H5-COO-+H2O | |
| 苯酚(C6H5-OH) | C6H5O-+CO2+H2O→C6H5OH+HCO3- |
| 盐酸、 | C6H5COO-+H+→C6H5COOH↓ |
 (3)A;将导管连接上A中的玻璃管,再将导气管的末端置于水中,用酒精灯对A中的试管微热,如果看到有气泡冒出,冷却后导气管的末端能回流形成一段水柱,说明A装置气密性良好。(4分)
(3)A;将导管连接上A中的玻璃管,再将导气管的末端置于水中,用酒精灯对A中的试管微热,如果看到有气泡冒出,冷却后导气管的末端能回流形成一段水柱,说明A装置气密性良好。(4分)