(12分)小明为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO2和NO,并验证其性质,装置图如下:
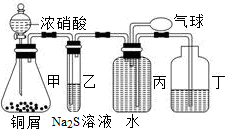
(1)写出甲中反应的离子方程式: ;
乙中的现象是____________ 可证明NO2的氧化性;
在丙中鼓入空气后现象是__________ 可证明NO的还原性。
(2)实验前丙中充满水的作用是 (用反应方程式和简要文字回答)。
(3)小华对小明的实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是___________________________ 。
你认为怎样才能准确证明NO2的氧化性?
_____________________________________ 。
(简要回答出原理和现象即可)
(12分)
(1)Cu+4H++2NO3-===Cu2++2NO2↑+2H2O(2分)
溶液变浑浊(1分) 有红棕色气体生成(1分)
(2)3NO2+H2O===2HNO3+NO,制取NO,并用排水法收集NO(3分)
(3)NO2和水反应生成的HNO3是一种氧化性酸,可将Na2S氧化,
使溶液变浑浊(2分)
可将干燥的NO2与干燥的H2S气体混合,若有淡黄色固体生成,
即可证明NO2的氧化性(3分)
各装置的作用:甲制备NO2、NO,乙、NO2氧化S2―,丙排水法收集NO,并用空气将其氧化,证明NO的存在。
⑴甲中反应Cu+4H++2NO3-===Cu2++2NO2↑+2H2O,乙中NO2+S2―+2H+ =S↓+NO+H2O,乙中的现象是溶液变浑浊,丙中鼓入空气,2NO+O2=2NO2,现象是有红棕色气体生成。
(2)丙中充满水的作用是将NO2转化为NO, 发生反应:3NO2+H2O=2HNO3+NO,制取NO,并用排水法收集NO。
⑶)NO2和水反应生成的HNO3是一种氧化性酸,可将Na2S氧化,使溶液变浑浊,证明NO2的氧化性,可将干燥的NO2与干燥的H2S气体混合,若有淡黄色固体生成,即可证明NO2的氧化性。本题主要考查思维的严密性。
