某化学探究学习小组设计如下图装置制取硝酸(夹持和加热仪器均已略去)。实验中可供使用的药品有:Na2CO3、NaHCO3、NH4HCO3、Na2O2、NaOH溶液和水。
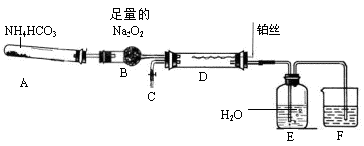
请回答下列问题:
(1)装置A中发生的化学反应方程式是 。
(2)撤去装置D中的加热装置后,铂丝仍然保持红热,这是因为D中发生的化学反应是一个 (填“放热”或“吸热”)反应。
(3)装置F中盛放的是 溶液,其作用是 。
(4)实验过程中,要使NH4HCO3充分转化为HNO3,还要在装置D中通入过量的氧气。甲同学提议在C处连接一个制取氧气的装置,乙同学认为可直接在A中再加入上述提供药品中的一种物质,这种药品的化学式是
(1)NH4HCO3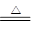 NH3+H2O+CO2↑
NH3+H2O+CO2↑
(2)放热
(3)NaOH 吸收可能未反应的氮氧化物,防止污染空气
(4)NaHCO3
制取硝酸涉及反应为:
4NH3+5O2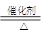 4NO+6H2O 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
4NO+6H2O 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
所给装置及药品可看出:NH4HCO3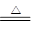 NH3+H2O+CO2↑ 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
NH3+H2O+CO2↑ 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
(1)NH4HCO3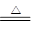 NH3+H2O+CO2↑
NH3+H2O+CO2↑
(2)氨气的催化氧化:4NH3+5O2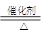 4NO+6H2O为放热反应
4NO+6H2O为放热反应
(3)反应过程中生成可污染空气的NO和NO2,一般采用碱液将其吸收
(4)可以加入NaHCO3,通过其分解生成的H2O及CO2,再与Na2O2反应得到氧气