(12分)
某学习研究小组根据金属锌、铝、铁分别与稀盐酸反应的相对速率,探究金属锌、铝、铁的金属活动性。
[实验设计]
为了达到实验目的.必须控制实验条件。你认为控制的实验条件是(可填满也可不填满
(1) ;(2) ;
(3) ;(4) 。
[实验探究]
该学习研究小组在上述实验条件相同的情况下,进行三组实验:各量取50mL稀盐酸于小烧杯中,分别同时加入足量的三种表面无氧化膜的金属片,用pH计测定溶液的pH并将信息传输到电脑,电脑动态地绘制出溶液中c(H+)随时间t的变化曲线(反应过程中溶液的体积没有变化)。下图是反应到t1s时电脑记录的曲线:
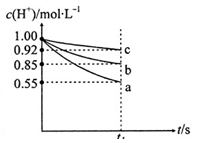
[交流与表达]
根据上述c(H+)随时间t的变化曲线回答下列问题:
(1)表示金属活动性最弱的金属与H+反应的变化曲线是 (填“a”、“b”或“c”编号)。
(2)在同一时间内,表示不同反应的反应速率可以有:同温同压下放出氢气的体积V(H2);溶液中H+浓度的减少△c(H+);固体减少的量△m或△n。在0一t1s之间,设A1和Zn分别与盐酸反应的速率为v(Al)和v(Zn):
A若以溶液中c(H+)减少来表示不同反应的速率,即v(Al)和v(Zn)的比值为 ;
B若以固体质量的减轻来表示不同反应的速率,即v(Al)和v(Zn)的比值为 ;
C若以固体物质的量减少来表示不同反应的速率,即v(Al)和v(Zn)的比值为 。
[实验设计]
(1)反应体系的温度相同;(2)盐酸的浓度相同;
(3)盐酸的体积相同;(4)金属的表面积相同。(每空1分)
[交流与表达](1)c(2)A:3 B:0.83 C:2(各2分)
本实验是采取控制变量的方法根据金属锌、铝、铁分别与稀盐酸反应的相对速率来探究金属锌、铝、铁的金属活动性,而反应速率受温度、浓度、催化剂、表面积、压强等内外因的影响,而金属活动性是内因,因此要控制外界条件相同,如反应体系的温度相同;盐酸的浓度相同;盐酸的体积相同;金属的表面积相同;由图知c(H+)浓度变化最小的是c,即反应速率最慢,金属性最弱,abc对应的金属分别为铝锌铁;(2)A:v(Al)和v(Zn)的比值为0.45/0.15=3 B:消耗的铝质量m(Al)=27х0.45х50х10-3/3,m(Zn)=65х0.15х50х10-3/2,m(Al)/(Zn)=0.83 C:铝锌的物质的量减少分别为0.45х50х10-3/3、0.15х50х10-3/2,二者的比为2。
