(14分)
室温下,已知HCl溶液与NaOH溶液的酸碱滴定曲线如下图所示:
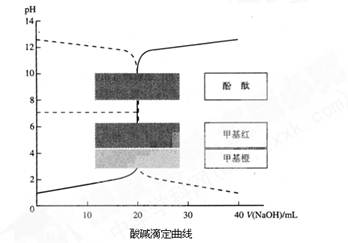
(1)向一定量的NaOH溶液中滴加HCl溶液的曲线为图中 (填“实线”或“虚线”)。
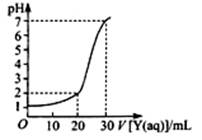
(2)上图为对10mL一定物质的量浓度的NaHSO4溶液X用一定物质的量浓度的氢氧化钠溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度分别是 和 。
(3)某研究性学习小组的研究课题:食醋中总酸量(g/100mL)的测定。他们进行以下滴定操作:
A.取某品牌白醋25.00mL置于 (填仪器名称)中,用蒸馏水稀释10倍。
B.用 (填仪器名称)量取稀释后的白醋溶液20.00mL,置于250mL锥形瓶中,滴入 (填指示剂名称)1~2滴。
C.用0.05 mol·L?1NaOH标准溶液滴定,至终点。记下初始与终点读数。
(注意:滴定重复进行3次。)
根据以上操作,请你继续回答下列问题。
①操作(C)中,滴定时,两眼注视 ;终点现象是 。
②误差分析:下列操作中能使测定结果偏高的是 。
a.稀释白醋的蒸馏水预先未经过煮沸处理
b.盛NaOH溶液的碱式滴定管未用标准液润洗
c.滴定前读数正确,滴定终点时俯视读数
d.接近终点时,用少量蒸溜水洗涤锥形瓶
③如果该小组检测结果与该品牌商标上所注不一致,可能的原因之一是 。
(14分)
(1)虚线 (2分) (2)0.09 mol·L?1 0.03 mol·L?1 (每空2分)
(3)(A)250mL容量瓶(1分)
(B)酸式滴定管(1分),酚酞试液(1分)
①锥形瓶中溶液颜色的变化。(1分)
溶液由无色变为浅红色,且在30s内不褪色。(1分)
②a、b(2分)
③食醋稀释时,体积控制不当,实际稀释倍数大于理论释释倍数;试样量取体积偏小;滴定终点颜色不足30s褪去;滴定结束后在碱式滴定管的尖嘴处有气泡;制造商加水过度稀释等。(1分)
考查酸碱中和滴定
(1)向一定量的NaOH溶液中滴加HCl溶液时,混合溶液的pH逐渐减小,故符合虚线
(2)设X和Y的物质的量浓度分别CX、CY,根据图示可得到以下两等式:
0.01CX=0.03CY 0.01=(0.01CX—0.02CY)/0.03
解得:CX=0.09 mol·L?1、CY=0.03 mol·L?1
(3)A:精确的配制、稀释溶液的容器为容量瓶
B:精确量取酸性液体可采用酸式滴定管;由于用强碱滴定弱酸,中和时溶液水解呈碱性,最好采用变色范围为碱性区域的指示剂,即酚酞
C:①酸碱滴定时,左手握活塞,右手旋转锥形瓶,两眼注视锥形瓶中溶液颜色的变化;
终点现象是溶液由无色变为浅红色,且在30s内不褪色
②a.蒸馏水消毒时一般用氯气,形成酸性物质,故将消耗的碱液偏多,测定结果偏高
b.盛NaOH溶液的碱式滴定管未用标准液润洗将使标准液的浓度偏小,标准液的体积偏大,测定结果偏高
c.滴定前读数正确,滴定终点时俯视读数,将使标准液的体积偏小,测定结果偏低
d.无影响
③制造商加水过度稀释等
