22、某研究小组按图示方向将A装置与下面所示装置相连,设计实验,研究铁与浓硫酸的反应。请你帮助完成下列实验报告,并回答有关问题。
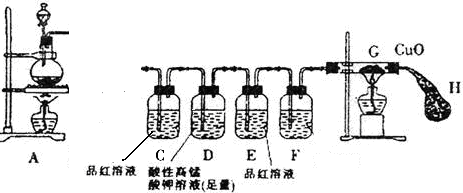
| 实验现象 | 结论及解释 | |
| ①将铁钉(足量)加入烧瓶中,再向其中滴加含amolH2SO4的浓硫酸溶液 | 未见明显现象 | 原因: 。 |
| ②点燃A、G处酒精灯 | 片刻后,烧瓶中溶液的颜色发生变化,并有气泡产生。C中溶液颜色 ,E中溶液未见明显变化。一段时间后,黑色的CuO变成了红色,此时E装置溶液颜色仍未有颜色变化 | 烧瓶中发生的所有反应 的化学方程式:
说明产生的SO2气体完全被D中溶液吸收 |
(1)连接好装置后,盛放药品前,首先要进行 操作。
(2)装置D的作用是 ,若现在实验室没有酸性高锰酸钾溶液,则D装置中的溶液可用 (填编号)代替
A、蒸馏水 B、浓硫酸 C、浓NaOH溶液 D、饱和NaHSO3溶液
(3)装置F中的溶液是 ,装置H的作用是:
(4)为了测定产生的SO2的量,实验后向烧瓶中加足量的盐酸至无气泡产生,再加足量的BaCl2溶液至沉淀完全,然后进行 、 、干燥、称量。为判断沉淀完全,应该进行的操作是: 。
(5)若(4)所得沉淀的质量为mg,则反应产生的SO2在标准状况的体积为:
L(列出计算式即可)
| 实验步骤 | 实验现象 | 结论及解释 |
| 原因:常温下铁被浓硫酸钝化。(2分) | ||
| 褪去 (1分) | 2Fe+6H2SO4(浓)= Fe2(SO4)3+3SO2↑+6H2O (2分) Fe+H2SO4(稀)=FeSO4+H2↑(2分) |
(2) 吸收SO2,(1分) C(1分)
(3) 浓硫酸,(1分)收集H21分)
(4) 过滤、(1分)洗涤(1分)
静置,在上层清液中继续加BaCl2溶液,若不再产生沉淀则沉淀完全。(3分,没写静置或上层清液的扣1分)
(5)(a-m/233)22.4(3分)
实验目的为了研究铁与浓硫酸的反应并检验产物,第一次用品红溶液检验SO2酸性高锰酸钾为了除去SO2,第二次用品红是检验SO2是否除尽,防止干扰CO2的检验。
