问题
填空题
有下列七种溶液:
A.氢氧化钠溶液;
B.氢氧化钡溶液;
C.硫酸铝溶液;
D.明矾溶液;E、混有少量硝酸的硫酸镁溶液;F、氯化铁溶液;
任取其中的一种溶液(甲)逐滴加入到另一种溶液(乙)中至过量,观察到自始至终均有白色沉淀。试回答下列问题:
(1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充)
| 组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 甲 | B | |||||||
| 乙 | D |
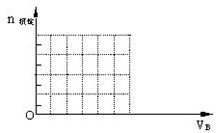
(3)下图是某一组实验中所得沉淀的物质的量(n沉淀/mol)随甲溶液中溶质的物质的量(n甲/mol)变化的曲线。符合下图曲线的试剂组合是:甲 (填化学式);乙 (填化学式)。

若实验时取用的乙溶液为500 mL,试计算乙溶液中溶质的物质的量的浓度
答案
(1)
| 组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 甲 | B | B | B | C | D | E | ||
| 乙 | D | C | E | B | B | B |
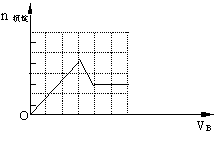
(3)甲: Ba(OH)2;乙:HNO3和MgSO4。HNO3:4 mol/L; MgSO4:6 mol/L
(1)要满足自始至终均有白色沉淀生成的,应该是
| 组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 甲 | B | B | B | C | D | E | ||
| 乙 | D | C | E | B | B | B |
(3)根据图像可知,开始即产生沉淀,且沉淀一直是增加的,共有3个拐点,所以符号条件的是氢氧化钡和混有少量硝酸的硫酸镁溶液。其中第一阶段是生成硫酸钡沉淀,第二阶段是硫酸钡和氢氧化镁的混合物,第三阶段是氢氧化镁沉淀,所以硝酸是2mol,浓度是4.0mol/L。消耗氢氧化钡是4mol,其中和硝酸反应的氢氧化钡是是1mol,所以生成氢氧化镁是3mol,则硫酸镁也是3mol,浓度是6.0mol/L。
