(5分)某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。
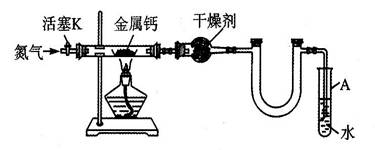
(1)按图连接好实验装置,检查装置的气密性的方法是 。
(2)反应过程中末端导管必须始终插入试管A的水中,目的是 。
(3)制备氮化钙的操作步骤是①打开活塞K并通入N2;②点燃酒精灯,进行反应;
③反应结束后, ;④拆除装置,取出产物。
(4)数据记录如下:
| 直玻管质量m0/g | 直玻管与钙的质量m1/g | 直玻管与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
(5分)
(1)关闭活塞K,加热直玻管,若导管口处产生气泡,停止加热后,导管中形成一段液柱,则气密性良好。
(2)防止反应过程中空气进入反应管,便于观察N2流速
(3)熄灭酒精灯,待反应管冷却至室温,停止通N2,并关闭活塞K
(4)①2.80
②x<3 O2和N2与等质量的Ca反应,生成CaO质量高于Ca3N2,导致计算出的n(N)偏大
由于金属钙为特别活泼的金属,故在制取Ca3N2的过程中,必须保证系统中无其它杂质气体,保证气密性良好:实验前先通入氮气,再加热,实验结束时,先停止加热、冷却后再停止通氮气
(2)防止空气从装置右端进入装置内,并且通过观察气泡来控制气体流速
(4)①由所给数据可知钙的质量为:15.08-14.80=0.28g,氮元素的质量为:15.15-15.08=0.07g,则两元素的原子个数比为: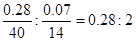 ,故x=0.28
,故x=0.28
②O2和N2与等质量的Ca反应,生成CaO质量高于Ca3N2,导致计算出的n(N)偏大,故x<3(或采用极值法来考虑:当气体全部为氧气时,得到的物质为CaO(即Ca2O2),而全部为氮气时得到的为Ca3N2,故通入的N2中混有少量O2时,所得物质的分子式中x<3)
