问题
实验题
(9分)某校一化学实验小组通过实验分析,确定一红色粉末为Fe2O3和Cu2O的混合物。
己知:①Cu2O溶于稀硫酸生成Cu和CuSO4,②Cu2O在空气中加热生成CuO。
(1)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为__________。
(2)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | 供选择试剂 | |
| Fe3+ | 1.9 | 3.7 | A.氯水, B.H2O2, C.NaOH, D.氨水, E.CuO, F.Cu2(OH)2CO3 |
| Fe2+ | 7.5 | 11 | |
| Cu2+ | 6.0 | 10 |
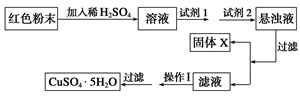
试回答:
①试剂1可以为________________,试剂2可以为________________。
②固体X的化学式为____________。
③操作Ⅰ为____________________。
答案
(1)×100%(3分)
(2)①B;(1分) EF (2分) ②Fe(OH)3(1分) ③蒸发浓缩、冷却结晶(2分)
(1)氧化亚铜生成氧化铜的方程式为2Cu2O+O2 4CuO,所以根据差量法可知,氧化亚铜的质量是
4CuO,所以根据差量法可知,氧化亚铜的质量是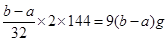 ,所以混合物中Cu2O的质量分数为×100%。
,所以混合物中Cu2O的质量分数为×100%。
(2)①混合物溶液稀硫酸中,生成硫酸铜、铜和硫酸铁,所以应该加入双氧水氧化单质铜,即试剂1是B;试剂2是原来调节溶液pH值的,由于不能引入杂质,所以反应是EF。
②通过调节pH可以生成氢氧化铁沉淀,则X是Fe(OH)3。
③要得到硫酸铜晶体,应该通过蒸发浓缩、冷却结晶,最后过滤得到。
