(10分)为测定乙炔的相对分子质量,某小组利用下图所示装置进行试验(夹持仪器已略去,气密性已检验)。
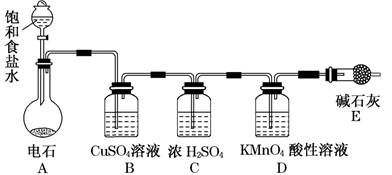
(1)小组查阅资料得出:乙炔能与硫酸酸化的KMnO4反应生成Mn2+和CO2,该反应的化学方程式是 。
(2)在装置A中使用饱和食盐水而不直接滴加水的原因 。
(3)B中的CuSO4溶液用于除去乙炔中混有的H2S、PH3、AsH3等气体,CuSO4溶液除H2S气体的反应类型是 (基本反应)。
(4)实验前D中含有x mol KMnO4的酸性溶液,实验时向D中通入一定量的乙炔直至KMnO4酸性溶液恰好完全褪色,实验完毕后装置D及E的总质量共增重y g,通过计算求出所测乙炔的相对分子质量(用含字母x、y的代数式表示):__________(不写计算过程)。
(5)若该小组的实验原理及所有操作都正确,下列因素中,对所测乙炔相对分子质量的值不会产生影响的是________。
A.将装置A中产生的混合气体直接通入D中的KMnO4酸性溶液
B.将E装置(盛有碱石灰的干燥管)换成盛有浓硫酸的洗气瓶
C.通入过量纯净的乙炔气体于KMnO4酸性溶液时,有部分乙炔未被氧化而逸出
(6)另一活动小组的同学认为上述实验装置仍存在不足,则改进的措施是______________。
(10分)
(1) C2H2+2KMnO4+3H2SO4===K2SO4+2MnSO4+2CO2↑+4H2O--------------2分
(2)为了减缓电石与水的反应速率 ----------------------------------------------------1分
(3) 复分解反应 ----------------------------------------------------------------------------1分
(4) 2 y/x ------------------------------------------------------------------------------------2分
(5)C ----------------------------------------------------------------------------------------2分
(6)在E装置后面再接一个盛有碱石灰的干燥管 (合理答案均给分)-------------2分
本题为一个定量实验题,设计氧化还原反应,有机反应,计算相关问题。整个流程为:制取→除杂(硫化物、水)→反应(定量)→吸收尾气。(1)该反应的反应物,产物均给出,关键问题是配平,Mn降低5价,C2H2中C取平均价态(-1),故升高5价,配平结果为:
C2H2+2KMnO4+3H2SO4=K2SO4+2MnSO4+2CO2↑+4H2O;(2)该反应速率快,用食盐水代替水,可以减缓反应速率;(3)该反应为CuSO4+H2S=CuS↓+H2SO4;为复分解反应;(4)增加的质量为乙炔的质量,其物质的量为mol,M===;(5)根据M=,其误差组要为增加质量的误差,气体没有净化,可使质量增加,使用浓硫酸洗气,不能吸收CO2,会使质量减小,只有C不影响。(6)该实验最后,空气中的二氧化碳和水蒸气可能进入E,使其质量增加,可在其后面加一个干燥管进行改进。
