(12分)工业上可用下列装置来测定黄铁矿中硫的质量分数(忽略SO2、H2SO3与氧气的反应)
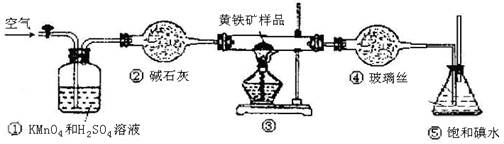
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取,分液
H.取20.00mL吸收液,用标准0.2000mol·L-1的NaOH溶液滴定。
试回答:
(1)已知:4FeS2 + 11 O2 = 2Fe2O3+ 8SO2 如12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的热化学方程式是 。
(2)步骤G中所用主要仪器是 ,应取 (填“上”或“下” )层溶液进行后续实验。
(3)装置①的作用是 。
(4)步骤H中滴定时应选用 作指示剂
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收。滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.58 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂 。
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液
(1)FeS2(S) + 11/4 O2 = 1/2Fe2O3(S) + 2SO2(g) △H=-853KJ/mol
(2)分液漏斗 上
(3)除去空气中的SO2和其他还原性气体
(4)酚酞(1分)滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色
(本问答甲橙和对应的现象给分,若浅红色答成红色不给分)
(5)24.0%
(6)B
(1)根据燃烧热概念,由所给信息可折算出,1molFeS2(120g)完全燃烧放热853kJ,故FeS2燃烧热的热化学方程式是FeS2(S) + 11/4 O2 = 1/2Fe2O3(S) + 2SO2(g) △H=-853KJ/mol
(2)萃取的主要仪器为分液漏斗
CCl4密度大于水,故萃取碘后,有机层在下层,水溶液为上层,后续实验是酸碱滴定,故需要取上层水溶液
(3)装置①装有酸性高锰酸钾溶液,具有强氧化性,可氧化除去空气中的还原性成分,提高实验的准确率
(4)强酸强碱滴定终点常用的指示剂包括甲基橙或酚酞
(5)对于多次测量数据一般要求平均值进行数据处理,由于第一次所消耗标准液的体积与后两次相关较大,为减小误差,只求后两次标准液的体积的平均值:20.00ml
由关系式S~SO2~4H+~4OH—可知:样品中硫元素的质量为: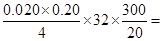 0.48g,所以,样品中硫元素的质量分数为24%
0.48g,所以,样品中硫元素的质量分数为24%
(6)装置⑤所得溶液为HI、H2SO4的混合溶液,为测得硫的质量分数,最好选用能与SO42—反应生成不溶于酸性溶液的沉淀,即氯化钡符合题意,答案为B
