为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。请填空:
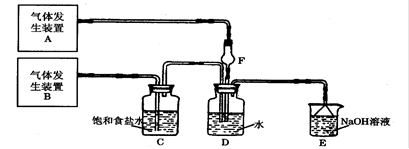
(1)D装置中主要反应的离子方程式为 ,F仪器的作用是 。
(2)为验证通入D装置中的气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
a 氯化铁稀溶液 b 氯化亚铁溶液 c 硫氰化钾溶液
d 苯酚溶液 e 品红溶液 f 酸性高锰酸钾溶液
①若Cl2过量:取适量D中溶液滴加至盛有 (选填一个符号)试剂的试管内,再加入 (选填一个符号)试剂,发生的现象是: ;
②若选用上述试剂中的一种再结合必要的操作就可以验证通入D装置中的气体是Cl2过量还是SO2过量,该试剂是 (选填一个符号)。必要的操作和结论是 。
(共12分)(1)Cl2+SO2+2H2O=4H++2Cl―+SO42- (2分); 防倒吸(2分);
(2)① b (1分); c(或d)(1分); 溶液呈红色(或紫色)(2分);
② e(2分);品红褪色,加热不复原,说明氯气过量;品红褪色,加热又复原,说明二氧化硫过量。(2分)
题目分析:(1)氯气具有氧化性,能把SO2氧化生成硫酸和盐酸,反应的离子方程式是Cl2+SO2+2H2O=4H++2Cl―+SO42-。由于SO2易溶于水,也易与水反应,且溶解度较大会发生倒吸,则F装置的作用是防止倒吸。
(2)①若Cl2过量,则所得溶液具有强氧化性,能把亚铁离子氧化生成铁离子,据此可以通过检验铁离子来检验氯气是否过量,即答案选b、c或d。
②因氯气和二氧化硫都具有漂白性,则选择品红来检验是Cl2过量还是SO2过量,即答案选e。若品红褪色,加热不复原,说明氯气过量;品红褪色,加热又复原,说明二氧化硫过量。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养。该题的关键是明确物质的性质及发生的化学反应,并能灵活运用即可。
