问题
实验题
用 NH4Cl进行如下实验,试判断发生的现象,并简单说明原因。
(1) 用玻璃棒蘸取少量 NH4Cl溶液与pH试纸接触时,试纸显示的颜色与标准比色卡相比,可发现 NH4Cl溶液的pH 7(填“<”、“=”或“>”),显 性(填“酸”、“碱”或“中”),其原因可用离子方程式表示为 ;
(2)在NH4Cl溶液中加入镁粉,可观察到有气体生成,其主要成分为 。
(3) 25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应 B.氯化铵溶液水解显酸性,增大了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
答案
(1)< 酸 NH4++H2O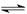 NH3·H2O+H+
NH3·H2O+H+
(1)H2 (3)C
(1)NH4Cl是强酸弱碱盐,NH4+水解显酸性,方程式为NH4++H2O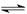 NH3·H2O+H+。
NH3·H2O+H+。
(2)氯化铵显酸性,所以能和镁反应产生氢气。
(3)氨水中存在电离平衡NH3·H2O NH4++OH-。加入少量氯化铵固体,增大NH4+浓度,抑制氨水的电离,所以碱性降低,pH减小,答案选C。
NH4++OH-。加入少量氯化铵固体,增大NH4+浓度,抑制氨水的电离,所以碱性降低,pH减小,答案选C。
