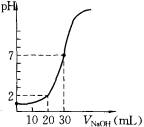
(14分)用一定物质的量浓度的NaOH溶液滴定10.00 mL已知浓度的盐酸,滴定结果如图所示。回答下列问题:
(1)有关滴定的操作可分解为如下几步,并补充完整。①用NaOH溶液润洗滴定管。②取NaOH溶液注入碱式滴定管至“0”刻度以上2~3 mL。③ ④调节液面至“0”或“0”刻度以下,记下读数。⑤移取10.00 mL盐酸注入锥形瓶中,加入酚酞。⑥把锥形瓶放在滴定管的下面,用氢氧化钠溶液滴定并记下读数。
(2)若滴定前俯视滴定管读数,滴定后平视刻度读数,则会使氢氧化钠浓度的测定结果 (填“偏高”“偏低”或“不变”)。
(3)如用酚酞作指示剂,则滴定终点的实验现象是 。
(4)c(HCl)= mol·L-1
(5)c(NaOH) = mol·L-1
(6)右图表示50 mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号) 。
A.是a mL
B.是(50-a)mL
C.一定大于a mL
D.一定大于(50-a)mL(7)常温下,用0.01 mol•L-1H2SO4溶液滴定0.01 mol•L-1 NaOH溶液,中和后加水至100 ml。若滴定到终点时少加一滴H2SO4(设1滴为0.05 ml)。则此时溶液的pH为 。
(1)调节滴定管尖嘴使之充满溶液(2)偏低
(3)最后一滴滴入后,锥形瓶中溶液恰好出现红色,且半分钟内红色不褪去
(4)0.09 (5)0.03 (6)D (7)9
(1)碱式滴定管在装入标准液后需要调节滴定管尖嘴使之充满溶液。
(2)滴定管自上而下刻度线是逐渐增大的,所以滴定前俯视滴定管读数,读数是偏小的,则企氢氧化钠的体积偏大,结果就偏低。
(3)由于是氢氧化钠滴定盐酸,所以终点时的现象是最后一滴滴入后,锥形瓶中溶液恰好出现红色,且半分钟内红色不褪去。
(4)根据图像可知,当加入2ml氢氧化钠时,溶液的pH是1。终点时消耗氢氧化钠的体积是30mol,所以盐酸的浓度是氢氧化钠的3倍,则 ,解得x=0.03mol/L,所以盐酸的浓度是0.09mol/L。
,解得x=0.03mol/L,所以盐酸的浓度是0.09mol/L。
(5)见(4)
(6)由于滴定管的最下端是不带刻度线的,所以滴定管中溶液的体积应大于(50-a)mL。
(7)一滴硫酸中氢离子的物质的量是0.05 ml×10-3×2×0.01 mol/L=10-6mol/L,所以过量的氢氧化钠是10-6mol/L,因此c(OH-)=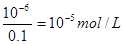 ,则氢离子浓度是10-9mol/L,pH等于9.
,则氢离子浓度是10-9mol/L,pH等于9.
