(14分)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
[实验1]铜与浓硫酸反应,实验装置如图所示。

实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为 。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是 。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
[实验2]实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图的实验:
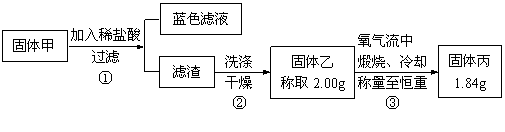
(4)②中检验滤渣是否洗涤干净的实验方法是
(5)③中在煅烧过程中一定发生的反应的化学方程式为 。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项) 。
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S
D.固体甲中若存在Cu2O,也可能有Cu2S
(共16分)
(1)2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O (2分)
CuSO4+SO2↑+2H2O (2分)
(2)试管A中气体压强减小,空气从D导管进入试管A中 (2分)
(3)从D管口向A中大量鼓气 (2分)
(4)取最后一次洗涤后所得液体于试管中,滴加硝酸银溶液,若无白色沉淀产生,则说明沉淀洗涤干净;若有白色沉淀生成,则说明未洗干净 (2分)
(5)2CuS+3O2 2CuO+2SO2 (条件也可为“煅烧”) (3分)
2CuO+2SO2 (条件也可为“煅烧”) (3分)
(6)BCD (3分)
本题的装置图源于教材,并不复杂,学生能够有很低的入手点,但是装置又有一定的创新,(装置中插入一根玻璃管)。这样对于学生既熟悉又陌生。从中考察了学生气压的知识。本题的难点是对于实验二的探究过程。本题是以研究一种具体的未知物质为出发点,可以说联系了实际问题。另外,该探究过程给出了很多的新信息,这就考察了学生接受,整合,应用新信息的能力。在本次探究过程中,还考察了电子守恒的方法对于氧化还原反应的配平。本次考试中没有一道计算题,但是本题中就揉合了计算的方法知识。在判断最后固体乙的组成时,需要用到差量计算的方法。最后的第6问考察将整个问题综合考虑的能力,要将所有探究的信息整合在一起才能够得出正确的结论。
(1)装置A中发生反应的化学方程式为2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是试管A中气体压强减小,空气从D导管进入试管A中。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是从D管口向A中大量鼓气。
(4)②中检验滤渣是否洗涤干净的实验方法是取最后一次洗涤后所得液体少许于试管中,滴加硝酸银溶液,若无白色沉淀产生,则说明沉淀洗涤干净;若有白色沉淀生成,则说明未洗干净。
(5)经分析固体甲加入稀盐酸后,得到的蓝色溶液,说明固体甲的成分中CuO和Cu2O至少有一种。分析反应:Cu + O2 =" CuO" 增重;Cu2S+2O2= 2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2减重。因题给“固体乙称取2.00g,氧气流中煅烧、冷却称量至恒重,得固体丙1.84g”,即实际减重了,说明必有CuS,还要有其他物质。既而再通过具体数据由差量法讨论:
①若有Cu2O, Cu2S可有可无;②若无Cu2O,必有Cu2S。故③中在煅烧过程中一定发生的反应的化学方程式为2CuS+3O2 2CuO+2SO2 (条件也可为“煅烧”)。
2CuO+2SO2 (条件也可为“煅烧”)。
(6)经上分析,对于固体甲的成分的判断中,正确的是BCD。
