(8分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用带刻度的集气瓶排水法收集氢气,每隔1分钟记录一次数据(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
造成这种变化的主要因素是 ;从3~5分钟时间段内,产生氢气的速率是如何变化的?答: 。造成这种变化的主要因素是 。
(2)在盐酸中分别加入等体积的下列溶液,能减缓反应速率而又不减少产生氢气的量的是 。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
(3)在0~1、1~2、2~3、3~4、4~5分钟五个时间段中,反应速率最大的时间段的盐酸的反应速率为 (设溶液体积不变,上述气体体积为标况下数据)。
(1)反应速率逐渐增大(1分);锌与盐酸反应放热,使溶液温度升高(1分);
反应速率逐渐减小(1分);随着反应进行,c(H+)逐渐减小(1分)。
(2)A 、B (2分) (3)0.1 mol/(L•min)(2分,单位错、漏得0分)
(1)根据表中数据可知,在0~1、1~2、2~3内生成的氢气分别是(ml)50、70、112,所以反应速率逐渐增大,这是由于锌与盐酸反应放热,使溶液温度升高,反应速率增大。在3~4、4~5内生成的氢气分别是(ml)58、20,所以反应速率逐渐减小,这是由于随着反应进行,c(H+)逐渐减小,反应速率逐渐减小。
(2)稀释能降低氢离子浓度,但不减少氢离子的物质的量,所以A正确。氯化钠溶液也是相当于稀释,B正确。碳酸钠能消耗氢离子,导致生成的氢气减少,C不正确,锌能置换出铜,从而构成原电池,加快反应速率,D不正确。答案选AB。
(3)根据(1)可知,在2~3内生成的氢气最多,氢气的物质的量是0.005mol,消耗盐酸是0.01mol,所以盐酸的反应速率是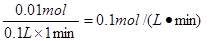 。
。
