某铝合金中含有单质铝、镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验流程,请回答有关问题:
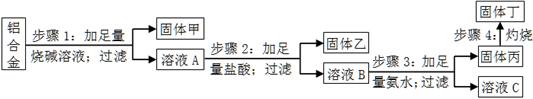
(1)步骤1所得固体甲的成分为 。
(2)步骤2中加足量盐酸,而不采用通入足量二氧化碳的原因为 。
(3)步骤3中生成固体丙的离子方程式为 ;溶液C中所含有的阳离子符号为 。
(4)步骤4所发生反应的化学方程式为 。
(5)现用托盘天平称取10.0g铝合金进行上述流程图所示操作,所得固体丁质量为15.3g,则该铝合金中铝的质量分数为 ;并判断以下操作对铝质量分数测定的影响(填“偏大”、“偏小”或“无影响”)。
a.步骤1中烧碱量不足,则 ;
b.步骤4中灼烧不充分,则 。
(16分)
(1)镁、铜(2分)
(2)通入二氧化碳得到硅酸与氢氧化铝的固体混合物,无法将硅、铝元素分离开来。(2分)
(3)Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+(3分);Na+、NH4+(2分)
(4)2Al(OH)3 Al2O3 + 3H2O(3分)
Al2O3 + 3H2O(3分)
(5)81.0%(2分);偏小(1分);偏大(1分)
题目分析:(1)镁、铜不与烧碱溶液反应,故固体甲的成分为镁、铜。
(2)氢氧化铝沉淀可以和盐酸反应,而不能和二氧化碳反应,故不采用通入足量二氧化碳的原因是通入二氧化碳得到硅酸与氢氧化铝的固体混合物,无法将硅、铝元素分离开来。
(3)氢氧化铝沉淀不再与氨水反应,故步骤3中生成固体丙的离子方程式为Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+。溶液C中所含有的阳离子符号为Na+、NH4+。
(4)丙是氢氧化铝,故反应方程式为2Al(OH)3 Al2O3 + 3H2O。
Al2O3 + 3H2O。
(5)Al→1/2Al2O3
27g 51g
m 15.3g
51g×m=27g×15.3g
解得m=8.1g
故10.0g铝合金中铝的质量分数为81.0%。
a.步骤1中烧碱量不足,Al反应不完,故偏小。
b.步骤1中灼烧不充分,丁的质量将偏大,故铝质量分数测定要偏大。
点评:本题考查学生对实验与操作原理、物质的分离提纯、物质含量的测定、化学计算等,难度中等,清楚实验原理是解题的关键,是对所学知识的综合运用,需要学生具备扎实的基础与运用知识分析问题解决问题的能力。
