已知在pH为4-5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生欲用电解纯净的CuSO4溶液的方法,根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量。其实验过程如下图所示
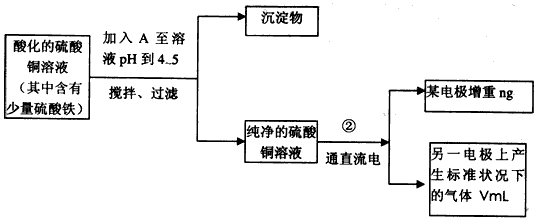
(1)符合条件的A可能是_______________
a.NH3·H2O b.Cu c.CuO d.Cu(OH)2
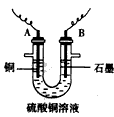
(2)过滤操作中用到的玻璃仪器有____________;步骤②中所用的部分仪器如图:则A连接直流电源的
____________ 极,B电极上发生的电极反应为___________________。
(3)电解开始一段时间后,在U形管中观察到的现象有_____________________
(4)下列实验操作中必要的是(填字母)_____________。
A.称量电解前电极的质量
B.电解后,电极在烘干称重前,必须用蒸馏水冲洗
C.刮下电解后电极上析出的铜,并清洗、称重
D.电极在烘干称重的操作中必须按“烘干一称重一再烘干一再称重,进行
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为____________(用带有n、V的计算式表示)。
(1)cd
(2)烧杯、玻璃棒、漏斗;负;4OH--4e-==O2↑+2H2O
(3)铜棒变粗,石墨极上有气泡生成,溶液的颜色变浅,2Cu2++2H2O==2Cu+4H++O2↑
(4)ABDE
(5)11200n/V
