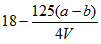某化学兴趣小组为探究铜跟浓硫酸的反应,用下图所示装置进行有关实验

请回答下列问题:
(1)试管Ⅰ中发生反应的化学方程式为:___________________________。
(2)可抽动铜丝的作用是___________________________。
(3)试管Ⅱ中现象为____________,可证明____________;试管Ⅲ中现象为____________,
可证明____________。
(4)试管Ⅲ的管口用浸有碱(NaOH溶液)的棉团塞住其作用是____________; 发生的反应为________________________。
(5)①实验开始时时,取ag铜丝和VmL18mol/L浓硫酸放在试管中共热。反应进行一段时间后,铜丝还有剩余,且能深入溶液内,但发现继续加热,铜丝不再溶解。该小组同学根据所学化学知识认为还有一定的硫酸剩余,你认为原因是________________________。
②该小组同学通过实验测得剩余铜丝质量为bg(假设反应前后溶液的体积不变),则剩余硫酸的物质的量浓度为____________mol/L。
(1)Cu+2H2SO4(浓)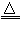 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)抽动铜丝,以随时中止反应
(3)品红溶液褪色;SO2具有漂白性;石蕊溶液显红色;SO2溶于水显酸性
(4)吸收SO2气体,防止空气污染;SO2+2NaOH==Na2SO3+H2O
(5)①反应过程中浓硫酸在被消耗的同时还有水生成,浓硫酸逐渐变稀,而铜不与稀硫酸反应
②