问题
实验题
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题
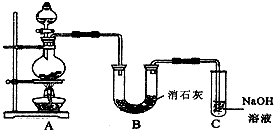
(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应原理为:
MnO2+4HCl(浓)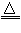 MnCl2+Cl2↑+2H2O,请在该反应方程式中标出电子转移方向和数目,
MnCl2+Cl2↑+2H2O,请在该反应方程式中标出电子转移方向和数目,
_________________________并指出氧化剂为_______________,还原剂为________________
(2)漂白粉将在U形管中产生,其化学方程式是____________________________
(3)C装置的作用是____________________________
(4)此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
____________________________
②试判断另一个副反应(用化学方程式表示)____________________________为避免此副反应的发生,可将装置作何改进____________________________
答案
(1)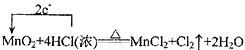 ;MnO2;HCl
;MnO2;HCl
(2)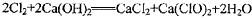
(3)吸收多余的氯气,防止氯气外逸污染空气
(4)①将U形管用冷水浴降温(或降温);
②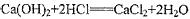 ;在A和B之间连接一个能吸收浓盐酸挥发出来的HCl的洗气瓶
;在A和B之间连接一个能吸收浓盐酸挥发出来的HCl的洗气瓶
