图Ⅰ是化学实验室中常用制备、干燥气体的部分仪器装置。某学校同学利用中学常用试剂及仪器设计下列实验。
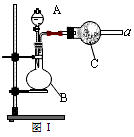

(1)图Ⅰ中仪器B的名称:_______________________。
(2)①同学甲利用图Ⅰ装置制备并收集干燥的NO2气体,请在方框内画出用集气瓶收集NO2的装置图(含尾气处理装置)。
②B中发生反应的离子方程式为________________。
(3)同学乙利用图Ⅰ装置通过称量反应前后C的质量,确定Na2CO3和NaCl固体混合物中Na2CO3的质量。A中加入稀硫酸,B中加入Na2CO3和NaCl固体混合物,C中加入碱石灰。该装置存在较多缺陷,从而导致实验误差较大,请你说出其中的两点缺陷:
①_________________________; ②_________________________。
(4)同学丙利用图Ⅰ装置制取氨气和氧气的混合气体,并且利用图Ⅱ装置验证氨的某些性质。A中加入浓氨水,C中加入碱石灰,E内放置催化剂(铂石棉),按气流方向a→b→c→h连接各仪器。
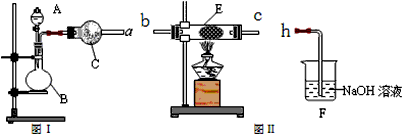
①B内需加入固体试剂的名称为____________________,B中能产生氨气和氧气混合气体的原因是____________________________________。
②实验中观察到E内有红棕色气体出现,证明氨气具有_________性,E中发生反应的两个化学方程式为:____________________________和2NO + O2 =2NO2。
(1)圆底烧瓶
(2)①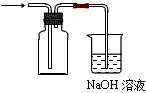 ;②Cu+4H++2NO3-==Cu2++ 2NO2↑+2H2O
;②Cu+4H++2NO3-==Cu2++ 2NO2↑+2H2O
(3)①没有吸收圆底烧瓶中水蒸气的装置(或CO2中混有的水蒸气也会被C吸收);
②干燥管与空气相通,空气中的CO2和水蒸气也会被吸收(或反应结束后,装置内残留的CO2不能完全排除)(答案合理即可)
(4)①过氧化钠;过氧化钠与浓氨水中的H2O反应生成氢氧化钠和氧气,同时放出大量热,温度升高使氨的溶解度减小而逸出,氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出
②还原性;4NH3+5O2 4NO+6H2O
4NO+6H2O
