(8分)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等。
⑴磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为____________。
⑵磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,
反应为:2Ca3(PO4)2+6SiO2= 6CaSiO3+P4O10 10C+P4O10= P4↑+10CO↑
上述反应中的各种物质,属于酸性氧化物的有 。
⑶白磷有剧毒,不慎沾到皮肤上,可用CuSO4溶液冲洗解毒。白磷可与热的CuSO4溶液反应生成磷化亚铜,与冷溶液则析出铜,反应方程式分别(均未配平)为:
① P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4
② P4+CuSO4+H2O→Cu+H3PO4+H2SO4
反应①中,氧化剂为 ,若上述两反应中被氧化的P4的物质的量相等,则消耗的CuSO4的物质的量之比为 。
(1)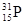 (2)SiO2 P4O10 (3)CuSO4和P4 1:1
(2)SiO2 P4O10 (3)CuSO4和P4 1:1
题目分析:(1)在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数。P元素的原子序数是15,所以表示该核素的原子符号为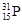 。
。
(2)能和碱反应生成盐和水的氧化物是酸性氧化物,所以属于酸性氧化物的 SiO2、P4O10。
(3)反应①中,硫酸铜中铜的化合价从+2价降低到+1价,得到电子,被还原,发生还原反应,因此硫酸铜是氧化剂。另外P元素的化合价从0价部分降低到-3价,得到电子,影响白磷也是氧化剂。如果被氧化的白磷都是1mol,则反应中转移电子是20mol,所以根据电子的得失守恒可知,反应①中需要硫酸铜是20/6×3=10mol。而在反应②需要硫酸铜是20÷2=10mol,所以消耗的CuSO4的物质的量之比为1︰1。
点评:本题综合性较强,难度较大,考查学生的分析能力。