请你协助化学兴趣小组的同学完成如下实验,并回答相关问题。实验目的:比较等体积0.5 mol·L-1硫酸、1 mol·L-1盐酸、1 mol·L-1醋酸分别与金属反应生成氢气的速率和体积。
(1)实验原理:(用离子方程式表示)________________。
(2)实验用品:仪器(略)、药品(除给定的三种酸溶液外,在Na、Mg、Fe三种金属中选择最合适的一种,并说明理由)。选择的金属是__________,不选其他两种金属的理由是__________________。
实验步骤:甲同学设计的实验装置:
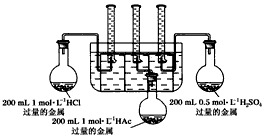
乙同学认为该装置不能控制三个反应在同一时间发生,并作了相应的改进。
(3)你认为乙同学改进的措施是__________________。
(4)按改进后的装置进行实验,观察现象并得出相关结论。实验现象及结论:________________________________________________________________________。
(5)反应开始时的速率:v(H2SO4)__________v(HCl)__________v(HAc)(用“=”“<”或“>”填空,下同),反应进行一段时间后的速率:v(H2SO4)<(HCl)__________v(HAc);
(6)最终得到的氢气体积:V(H2/H2SO4)__________V(H2/HCl)__________V(H2/HAc)。问题讨论:
(7)量筒的规格由__________________决定。
(8)对结论“(6)”“(7)”中盐酸和醋酸的异同,你的解释是__________________。
(9)根据现有知识,上述实验中硫酸和盐酸分别与金属反应的速率应始终都相等,但反应一段时间后有v(H2SO4)<v(HCl)。对此现象,你猜想可能的原因是__________________。大学无机化学对此问题将有科学的解释。
(1)2H++Mg=H2↑+Mg2+,2CH3COOH+Mg=H2↑+Mg2++2CH3COO-
(2)Mg;Na太活泼,能和水反应产生氢气,影响实验结论,Fe与酸反应的速率较慢,实验时间较长
(3)同时用分液漏斗分别向烧瓶中加入酸液
(4)实验现象:反应开始时醋酸反应速率小于盐酸和硫酸反应速率。当反应进行到一定程度后,醋酸的反应速率大于盐酸和硫酸。结论:最终得到的氢气体积相等
(5)=;>;<
(6)=;=
(7)酸液的体积
(8)醋酸中存在电离平衡,反应开始时c(H+)小于盐酸,故反应速率也小于盐酸。当反应进行到一定程度后,醋酸的电离平衡不断向右移动,使得c(H+)大于盐酸,故反应速率大于盐酸。由于醋酸、盐酸最终提供的H+的物质的量相等,故最后得到H2体积相等
(9)H+的存在抑制HSO4-的电离(或:SO4-抑制H+与Mg的反应或Cl-促进H+与Mg的反应)
