问题
实验题
某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
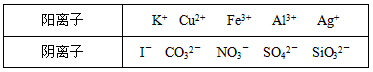
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,呈紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清。
Ⅲ.另取溶液加入BaCl2溶液,有白色沉淀生成,加稀硝酸沉淀无变化。请推断:
(1)由Ⅰ判断,溶液中一定含有的阳离子是_________(写离子符号)。
(2)Fe3+是否存在?______,判断的理由是__________________。
(3)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是_________________________。将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为_________________________
(4)甲同学最终确定原溶液中所含阳离子是________,阴离子是________。(写离子符号)
(5)另取100mL原溶液,加入足量的氨水,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为
_________g。
答案
(1)K+
(2)否;Fe3+与I-可发生氧化还原反应不能共存
(3)6I-+ 2NO3- + 8H+ = 3I2 + 2NO↑+ 4H2O; 3NO2+H2O=2HNO3+NO
(4)Al3+、K+ ;I-、NO3-、SO42-
(5)0.51g
