周期表中短周期6种元素A、B、C、D、E、F,原子序数依次增大。A的原子半径最小,A和D、C和F分别同主族,F的单质是黄色固体,B所形成的化合物种类最多,E的最外层电子数等于其电子层数。
(1)写出工业制备E单质的化学方程式____________________。
(2)写出一种由其中两种元素组成的既含极性键又含非极性键的18电子微粒________(写化学式)。
(3)由A、C元素组成的化合物甲与由D、C元素组成的化合物乙反应可制备O2,请写出乙的电子式__________。
(4)3mol DABC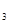 和2mol D
和2mol D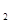 C
C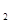 混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分及物质的量分别是____________________。
混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分及物质的量分别是____________________。
(1)2Al2O3 4Al+3O2↑(2)H2O2或C2H6
4Al+3O2↑(2)H2O2或C2H6
(3)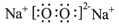 (4)3molNa2CO3 1molNaOH
(4)3molNa2CO3 1molNaOH
题目分析:A的原子半径最小,则A一定是氢元素;F的单质是黄色固体,所以F单质是硫磺。C和F同主族,所以C是氧元素。B所形成的化合物种类最多,化合物最多的是碳元素,则B是碳。E的最外层电子数等于其电子层数,E的原子序数大于碳元素而S元素,所以E是第三周期的Mg元素。A和D同主族,D的原子序数大于碳元素,而小于Mg元素,所以D是钠。
(1)镁是活泼的金属,通过电解法冶炼,所以工业制备镁单质的化学方程式2Al2O3 4Al+3O2↑。
4Al+3O2↑。
(2)由其中两种元素组成的既含极性键又含非极性键的18电子微粒是H2O2或C2H6。
(3)由A、C元素组成的化合物甲与由D、C元素组成的化合物乙反应可制备氧气,则甲是水,乙是过氧化钠,因此过氧化钠的电子式是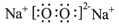 。
。
(4)DABC3和D2C2分别是碳酸氢钠和过氧化钠,碳酸氢钠加热易分解生成水、CO2和碳酸钠,反应的化学方程式是2NaHCO3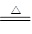 Na2CO3+CO2↑+H2O,3mol碳酸氢钠分解生成1.5mol碳酸氢钠、1.5molCO2和1.5mol水。由于水和过氧化钠反应生成氢氧化钠,而氢氧化钠又能和吸收CO2,所以当水蒸气和CO2共同存在时,过氧化钠首先和CO2反应,然后再和水蒸气反应。根据方程式2CO2+2Na2O2=2Na2CO3|+O2、2H2O+2Na2O2=4NaOH+O2可知,1.5molCO2消耗1.5mol过氧化钠,生成1.5mol碳酸钠。剩余的0.5mol过氧化钠和水蒸气反应生成1mol氢氧化钠,因此容器内残留物的成分及物质的量分别是3mol碳酸钠和1mol氢氧化钠。
Na2CO3+CO2↑+H2O,3mol碳酸氢钠分解生成1.5mol碳酸氢钠、1.5molCO2和1.5mol水。由于水和过氧化钠反应生成氢氧化钠,而氢氧化钠又能和吸收CO2,所以当水蒸气和CO2共同存在时,过氧化钠首先和CO2反应,然后再和水蒸气反应。根据方程式2CO2+2Na2O2=2Na2CO3|+O2、2H2O+2Na2O2=4NaOH+O2可知,1.5molCO2消耗1.5mol过氧化钠,生成1.5mol碳酸钠。剩余的0.5mol过氧化钠和水蒸气反应生成1mol氢氧化钠,因此容器内残留物的成分及物质的量分别是3mol碳酸钠和1mol氢氧化钠。
点评:该题是中等难度的试题,试题综合性强,对学生的要求高,有利于调动学生的学习兴趣,激发学生的学习积极性。准确判断出元素是答题的关键,难点是碳酸氢钠和过氧化钠混合加热的计算,注意明确CO2和水蒸气与过氧化钠反应的先后顺序。
