如图为部分短周期元素化合价与原子序数的关系图。请回答下列问题。
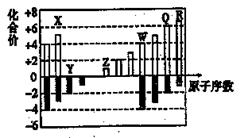
(1)元素Q位于周期表中第 周期______族。
(2)将X、Z、Q、R四种元素的氢化物各1mol和水混合后,分剜得到l L溶液,所得水溶液碱性最强的氢化物的电子式是 。
(3)Z的最高价氧化物对应的水化物与W的单质反应的化学方程式为 。
(4)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。RY2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50 g RY2时,共转移了1 mol电子。则反应的离子方程式是____。
⑴三(1分)ⅥA(1分)⑵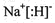 (2分)⑶Si+2NaOH+H2O=Na2SiO3+2H2↑(2分)⑷2ClO2+5Mn2++6H2O=5MnO2↓+2Cl―+12H+ (2分)
(2分)⑶Si+2NaOH+H2O=Na2SiO3+2H2↑(2分)⑷2ClO2+5Mn2++6H2O=5MnO2↓+2Cl―+12H+ (2分)
由表中化合价可知,Y的化合价为-2价,没有正化合价,故Y为O元素,X的化合价为+5、-3价,处于ⅤA族,原子序数比O元素小,故X为N元素,Z的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Z为Na元素,W的化合价为+4、-4价,处于ⅣA族,为Si元素,Q的化合价为+6、-2价,故Q为S元素,R的化合价为+7、-1价,故R为Cl元素,⑴Q的化合价为+6、-2价,故Q为S元素,位于第三周期,ⅥA族,答案:三(1分)ⅥA(1分);⑵将X、Z、Q、R四种元素的氢化物各1mol和水混合后,分别得到NH3·H2O,NaOH,H2S,HCl溶液,其中碱性最强的是由NaH形成的,NaH的电子式为: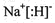 ,答案:
,答案: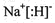 ;⑶Z的最高价氧化物对应的水化物NaOH与W的单质Si反应的化学方程式为Si+2NaOH+H2O=Na2SiO3+2H2↑,答案:Si+2NaOH+H2O=Na2SiO3+2H2↑;⑷RY2是ClO2可以用来除去水中超标的Mn2+,生成一种黑色沉淀MnO2,同时测得消耗ClO213.50 g /67.5 g·mol―1=0.2mol时,共转移了1 mol电子,即ClO2中Cl降5价变-1价。则反应的离子方程式是:2ClO2+5Mn2++6H2O=5MnO2↓+2Cl―+12H+ ,答案:2ClO2+5Mn2++6H2O=5MnO2↓+2Cl―+12H+ 。
;⑶Z的最高价氧化物对应的水化物NaOH与W的单质Si反应的化学方程式为Si+2NaOH+H2O=Na2SiO3+2H2↑,答案:Si+2NaOH+H2O=Na2SiO3+2H2↑;⑷RY2是ClO2可以用来除去水中超标的Mn2+,生成一种黑色沉淀MnO2,同时测得消耗ClO213.50 g /67.5 g·mol―1=0.2mol时,共转移了1 mol电子,即ClO2中Cl降5价变-1价。则反应的离子方程式是:2ClO2+5Mn2++6H2O=5MnO2↓+2Cl―+12H+ ,答案:2ClO2+5Mn2++6H2O=5MnO2↓+2Cl―+12H+ 。
考点:元素周期表、元素及化合物
