某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计的除去污水中的金属离子,回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
【药品】NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
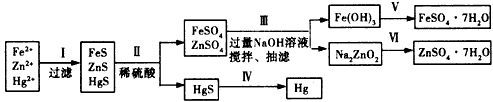
【问题探究】
(1)步骤Ⅱ所发生反应的离子方程式为____________________
(2)步骤Ⅲ中的抽滤为减压条件下的过滤,可以加快过滤速度;该步骤涉及反应的离子方程式有
Zn2++4OH-=ZnO22-+2H2O和_______________________
(3)步骤Ⅵ中得到硫酸锌溶液的离子反应方程式为_______________________
(4)欲实现步骤V,所需加入的试剂有____、____, 所涉及的主要操作依次为________________
(5)步骤Ⅳ常用的方法是___________,该步骤是否对环境有影响?_______(填“是”或“否”),如有影响,请你设计一个环境保护方案来实现步骤Ⅳ的反应____________________
(1)FeS+2H+=Fe2++H2S↑、ZnS+2H+=Zn2++H2S↑
(2)4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓
(3)ZnO22-+4H+=Zn2+ +2H2O
(4)稀硫酸;铁粉(过量);过滤、浓缩结晶、过滤
(5)加热;是;在密闭容器中加热HgS
