不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算。
(1)该小组设计了如下图所示的实验装置,检查该装置气密性的操作是___________。

(2)若在烧瓶中放入1.30 g锌粒,与c mol/LH2SO4反应,为保证实验结论的可靠,量气管的适宜规格是
_________。
A. 100 mL B. 200 mL C. 400 mL D. 500 mL
(3)若l.30 g锌粒完全溶解,氢氧化钠洗气瓶增重0.64 g,则圆底烧瓶中发生反应的化学方程式为________________________。
(4)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重bg,量气瓶中收集到VmL气体(标准状况),请用一个代数式表示出a、b、V之间的关系_______________。
(5)若撤走盛有无水氯化钙的U形管,则n(H2)/n(SO2)的数值将_________(填“偏大”“偏小”或“无影响”)。
(6)反应结束后,为了准确地测量气体体积,量气管在读数时应注意的事项是________、_______。
(1)关闭分液漏斗活塞,向右侧球形管中加入水,一段时间后观察球形管和量气管之间的液面差有无变化
(2)D
(3)Zn+2H2SO4 =ZnSO4 +SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑ 或2Zn+3H2SO4=2ZnSO4+SO2↑+H2↑+2H2O
(4)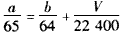
(5)偏小
(6)待冷却至室温再开始读数;读数前使量气管左右液面相平(或眼睛视线与液面最低处相平;答案合理即可)
