氨是一种重要化工原料,大量用于制造铵态氮肥、有机氮肥(如尿素),还用于制造硝酸。学生甲和乙欲制取氨气并探究其性质。
请回答:
(1)用硫酸铵与消石灰共热制取氨气的化学方程式:____________________。
(2)下图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是___________。
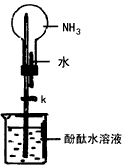
(3)学生甲和学生乙在相同环境下同时分别进行氨气喷泉的实验,学生甲实验时,水涌入烧瓶中占烧瓶体积的4/5,学生乙实验时,水涌入烧瓶中却只占烧瓶体积的1/5,假设烧瓶内液体没有溢散,他们制得氨水的物质的量浓度比是___________。
(4)氨气在空气中不能燃烧,为了探究在催化剂存在时氨气能否被空气氧化,他们合作进行下图所示的实验。
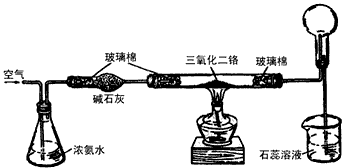
①实验时,先加热到三氧化二铬红热,并鼓入空气。停止加热后再继续鼓入空气,三氧化二铬保持红热,原因是____________________。
②氨催化氧化的化学方程式:_____________________。
③整个实验过程中,不会生成的物质是______。
A. N2 B.NO2 C.HNO3 D.NH4NO3
(5)将NH3通过灼热的CuO后得到红色物质Cu。
甲同学认为:NH3与CuO反应生成的红色物质Cu中可能含有Cu2O。
已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+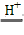 Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O__________
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O__________
(1)(NH4)2SO4+Ca(OH)2 CaSO4+2NH3↑+2H2O
CaSO4+2NH3↑+2H2O
(2)将胶头滴管中的水挤入烧瓶中,打开止水夹k
(3)1:1
(4)①NH3的催化氧化是放热反应;②4NH3+5O2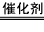 4NO+6H2O;③A
4NO+6H2O;③A
(5)取少量该红色物质于试管中,加入稀硫酸后,如果溶液呈蓝色,即证明该红色物质中含有Cu2O