X、Y、Z、Q、W、R六种短周期元素原子序数依次增大,化合物甲由X、Z、Q三种元素组成,常温下0.1mol/L甲溶液的pH=13,工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成。请回答以下问题:
(1)Q的原子结构示意图为 。
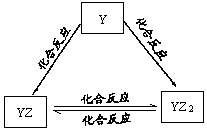
(2)Y元素的单质能发生如图所示的转化,则Y元素为 (用元素符号表示)。在甲溶液中通入足量YZ2气体,所得溶液呈碱性,原因是 (用离子方程式和必要的文字说明)。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为:
②Q、W两种元素金属性的强弱为Q W(填“>”、“<”) ;下列表述中证明这一事实的是 。
a.Q的单质的熔点比W单质低
b.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
c. W的原子序数大
(1) (1分);
(1分);
(2)C (l分);HCO3-+H2O CO32-+H3O+(或HCO3-
CO32-+H3O+(或HCO3- CO32-+H+)
CO32-+H+)
HCO3-+H2O H2CO3+OH—;HCO3-的水解程度大于电离程度(两个方程式和文字解释各1分,共3分)
H2CO3+OH—;HCO3-的水解程度大于电离程度(两个方程式和文字解释各1分,共3分)
(3)①2Al+2OH—+2H2O=2 AlO2-+3H2↑(3分);②>(2分);b(2分)
题目分析:X、Y、Z、Q、W、R六种短周期元素, 化合物甲由X、Z、Q三种元素组成,常温下0.1mol/L甲溶液的pH=13,可知为强碱NaOH,X、Z、Q分别为H、O、Na;工业上常用电解饱和NaCl溶液生成NaOH,所以R为Cl;结合图形可推知Y为C;W的单质既能与甲溶液反应,又能与乙溶液反应,为Al。
(1)Q是Na, 。
。
(2)结合图形可推知Y为C;HCO3-+H2O CO32-+H3O+(或HCO3-
CO32-+H3O+(或HCO3- CO32-+H+)HCO3-+H2O
CO32-+H+)HCO3-+H2O H2CO3+OH—;HCO3-的水解程度大于电离程度。
H2CO3+OH—;HCO3-的水解程度大于电离程度。
(3)①Al与NaOH溶液反应:2Al+2OH—+2H2O=2 AlO2-+3H2↑。②根据周期律可知金属性的强弱
